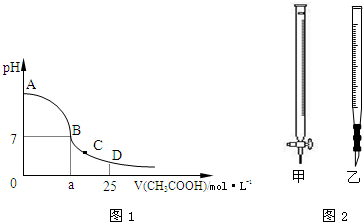
题目内容
 在25mL 0.1mol?L-1的NaOH溶液中逐滴加入0.2mol?L-1的CH3COOH溶液,溶液pH变化曲线如图所示.
在25mL 0.1mol?L-1的NaOH溶液中逐滴加入0.2mol?L-1的CH3COOH溶液,溶液pH变化曲线如图所示.(1)B点溶液呈中性,有人据此认为,在B点时NaOH溶液与CH3COOH溶液恰好完全反应,这种看法是否正确?
(2)在D点时,溶液中c(CH3COO-)+c(CH3COOH)
(3)在C点时,溶液中离子浓度由大到小的顺序:
分析:(1)氢氧化钠和醋酸溶液按照物质的量之比1:1反应生成的醋酸钠为强碱弱酸盐,溶液显碱性,pH>7;
(2)在D点时,氢氧化钠溶液和醋酸溶液反应后剩余醋酸,溶液的组成为等浓度的醋酸和醋酸钠的混合物;
(3)在C点,醋酸过量,为醋酸和醋酸钠的混合溶液,溶液显酸性.
(2)在D点时,氢氧化钠溶液和醋酸溶液反应后剩余醋酸,溶液的组成为等浓度的醋酸和醋酸钠的混合物;
(3)在C点,醋酸过量,为醋酸和醋酸钠的混合溶液,溶液显酸性.
解答:解:(1)溶液混合后发生的反应为:NaOH+CH3COOH=CH3COONa+H20,当醋酸和氢氧化钠的物质的量之比为1:1时,反应生成的CH3COONa为强碱弱酸盐,溶液显碱性,pH>7,介于AB之间,故答案为:否、AB;
(2)在D点时,反应后醋酸剩余,溶液的组成为等浓度的醋酸和醋酸钠的混合物,根据物料守恒,此时:c(CH3COO-)+c(CH3COOH)=2c(Na+),故答案为:=;
(3)在C点,醋酸过量,为醋酸和醋酸钠的混合溶液,溶液显酸性,醋酸大于醋酸钠的水解,则离子关系为c(CH3COO-)>c(Na+)>c(H+)>c(OH-),
故答案为:c(CH3COO-)>c(Na+)>c(H+)>c(OH-).
(2)在D点时,反应后醋酸剩余,溶液的组成为等浓度的醋酸和醋酸钠的混合物,根据物料守恒,此时:c(CH3COO-)+c(CH3COOH)=2c(Na+),故答案为:=;
(3)在C点,醋酸过量,为醋酸和醋酸钠的混合溶液,溶液显酸性,醋酸大于醋酸钠的水解,则离子关系为c(CH3COO-)>c(Na+)>c(H+)>c(OH-),
故答案为:c(CH3COO-)>c(Na+)>c(H+)>c(OH-).
点评:本题考查混合后离子浓度的大小比较,题目难度较大,考查学生分析和解决问题的能力,明确混合物溶液中的溶质是解答的关键,注意利用物理守恒及酸的强弱等来解答.

练习册系列答案
相关题目
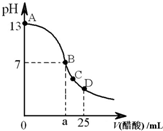 在25mL 0.1mol/L NaOH溶液中逐滴加入0.2mol/L醋酸,曲线如右图所示,有关叙述错误的是( )
在25mL 0.1mol/L NaOH溶液中逐滴加入0.2mol/L醋酸,曲线如右图所示,有关叙述错误的是( )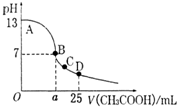 (2011?鹰潭二模)室温下,在25mL 0.1mol.L-1NaOH溶液中逐滴加入0.2mol?L-1 CH3COOH 溶液,pH 与滴加 CH3COOH溶液体积的关系曲线如图所示,若忽略两溶液混合时的体积变化,下列有关粒子浓度关系的说法错误的是( )
(2011?鹰潭二模)室温下,在25mL 0.1mol.L-1NaOH溶液中逐滴加入0.2mol?L-1 CH3COOH 溶液,pH 与滴加 CH3COOH溶液体积的关系曲线如图所示,若忽略两溶液混合时的体积变化,下列有关粒子浓度关系的说法错误的是( )