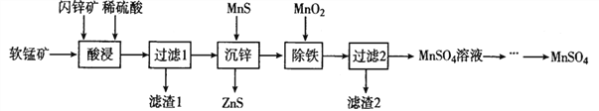
题目内容
【题目】设NA为阿伏加徳罗常数的值,下列说法正确的是
A.电解精炼铜时转移了NA个电子,阳极溶解了32g铜
B.室温下,pH=3的NH4Cl溶液中,由水电离的OH-浓度为10-11mol/L
C.12.0g熔融的NaHSO4中含有的阳离子数为0.1NA
D.常温下,1mol/LFe2(SO4)3溶液中,Fe3+和SO42-的离子总数是NA
【答案】C
【解析】
A.电解精炼铜实验中,阳极为粗铜,粗铜中含有的Zn、Fe等较Cu活泼的金属先放电,因此当转移了NA个电子,阳极不一定会溶解0.5mol铜(即32g铜),故A错误;
B.NH4Cl溶液中H+均由水电离,pH=3的NH4Cl溶液中c(H+)=c(H+)水=c(OH-)水=10-3mol/L,故B错误;
C.NaHSO4在熔融状态下电离方程式为:![]() ,12.0g NaHSO4的物质的量为
,12.0g NaHSO4的物质的量为![]() ,因此0.1mol NaHSO4所含阳离子数目为0.1NA,故C正确;
,因此0.1mol NaHSO4所含阳离子数目为0.1NA,故C正确;
D.未告知溶液体积,因此无法计算Fe3+和![]() 的数目,故D错误;
的数目,故D错误;
故答案为:C。

练习册系列答案
 一线名师提优试卷系列答案
一线名师提优试卷系列答案
相关题目