题目内容
(10分)短周期原子序数依次递增的A、B、C、D、E、F六种元素,已知B原子最外层电子数是A原子次外层电子数的3倍,是D原子最外层电子数的2倍;C原子内层电子总数是最外层电子数10倍;A、B、D三种元素的原子最外层电子数之和为13;A和B原子最外层电子数与D和F原子最外层电子数之和相等;D和E是相邻两种元素。
(1)E元素基态原子的核外电子占用了 个原子轨道;F元素的名称: _。
(2)A和E元素的最高价含氧酸的酸性较强的是__________;(填化学式)
(3)A、B、C三种元素组成原子个数比nA:nB:nC=1:3:2的化合物,用离子方程式表示该化合物的水溶液显碱性的原因__ _。
(4)B、C、D三种元素原子半径最大的是 (填元素符号),离子半径最小的是 (填离子符号)。M元素与D元素位于不同主族,但由于二者的电负性相近,导致某些性质相似。将M的最高价氧化物溶于C的氢氧化物的水溶液中,发生反应的离子方程式为
_。
(5)E和F形成的化合物X在高温条件下可以被氢气还原,工业上常用此反应制取高纯度的单质E,写出该化学反应的方程式 。
(1)8 氯 (2)H2CO3
(3)CO32-+H2O HCO3-+OH-
HCO3-+OH-
(4)Na Al3+ BeO+2OH-=BeO22-+H2O (2分)
(5)SiCl4+2H2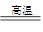 Si+4HCl(2分)
Si+4HCl(2分)
【解析】根据元素的结构及其性质可知,A、B、C、D、E、F六种元素分别是C、O、Na、Al、Si、Cl。
(1)根据构造原理可知,E元素基态原子的核外电子占用了1+1+3+1+2=8。
(2)非金属性越强,最高价氧化物的水化物的酸性越强,所以碳酸的酸性强于硅酸的。
(3)A、B、C三种元素组成原子个数比nA:nB:nC=1:3:2的化合物是碳酸钠,水解显碱性,方程式为CO32-+H2O HCO3-+OH-。
HCO3-+OH-。
(4)同周期自左向右原子半径逐渐减小,同主族自上而下原子半径逐渐增大,所以钠的原子半径最大。核外电子排布相同的微粒,其微粒半径随原子序数的增大而减小,所以最小的是Al3+ 。氧化铝是两性氧化物,所以氧化物BeO也是两性氧化物,和氢氧化钠反应的方程式为BeO+2OH-=BeO22-+H2O。
(5)高温下,氢气还原四氯化硅的方程式为SiCl4+2H2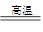 Si+4HCl。
Si+4HCl。

 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案 小学课堂作业系列答案
小学课堂作业系列答案