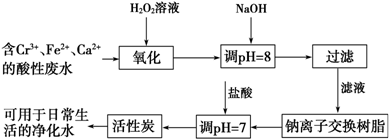
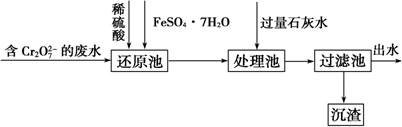
题目内容
4.设NA代表阿伏伽德罗常数,下列说法正确的是( )| A. | 标准状况下,22.4 L乙醇所含的分子数必定为NA | |
| B. | 1mol NO2与足量的水反应,转移的电子数为2NA | |
| C. | 0.1mol Fe粉与足量水蒸气反应生成的H2分子数为0.15NA | |
| D. | 在常温常压下32g氧气所含的原子数目为2NA |
分析 A、标况下乙醇为液态;
B、二氧化氮和水的反应为歧化反应;
C、铁与水蒸汽反应,3mol铁反应生成4mol氢气;
D、氧气由氧原子构成.
解答 解:A、标况下乙醇为液态,故乙醇的物质的量不能根据气体摩尔体积来计算,故A错误;
B、二氧化氮和水的反应为歧化反应,3mol二氧化氮转移2mol电子,故1mol二氧化氮转移$\frac{2}{3}$mol电子即$\frac{2}{3}{N}_{A}$个,故B错误;
C、铁与水蒸汽反应,3mol铁反应生成4mol氢气,故0.1mol铁生成的氢气的物质的量为0.133mol即0.133NA个,故C错误;
D、氧气由氧原子构成,故32g氧气中含有的氧原子的物质的量为n=$\frac{32g}{16g/mol}$=2mol,故为2NA个,故D正确.
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案
相关题目
12.按装置如图进行实验,若图的X轴表示流入阴极的电子的量,则Y轴不可能表示的( )


| A. | Ag+物质的量浓度 | B. | NO3-物质的量浓度 | ||
| C. | 溶液的pH | D. | 银棒的质量 |
19.下列四组物质中,前者属于电解质,后者属于非电解质的是( )
| A. | 二氧化碳碳酸钠 | B. | 硫酸钠乙醇 | C. | 盐酸甲烷 | D. | 蔗糖氢氧化钠 |
16.下列有关材料的叙述不正确的是( )
| A. | 水晶、陶瓷、玻璃的主要成分都是硅酸盐 | |
| B. | 合金的熔点通常比組分金属低.硬度比组合分金属高 | |
| C. | 自行车钢架生锈主要是电化学腐蚀所致 | |
| D. | 聚氯乙烯不能做食品包装袋 |
5.一定条件的密闭容器中:4NH3(g)+5O2(g)?4NO(g)+6H2O(g)△H=-905.9kJ•mol-1,下列叙述不正确 的是( )
| A. | NH3与O2起始时物质的量之比等于4:5,则平衡后两物质的转化率一定相等 | |
| B. | 平衡时4v正(O2)=5v逆(NO) | |
| C. | 平衡后降压,混合气体平均摩尔质量减小 | |
| D. | 达到平衡时放出热量为905.9 kJ,则起始时投入4mol NH3和5mol O2 |