题目内容
反应N2O4(g)  2NO2(g) ΔH=+57 kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是( )
2NO2(g) ΔH=+57 kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是( )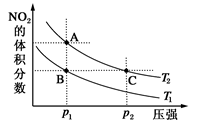
A.A、B两点的反应速率:A>B
B.B、C两点的反应平衡常数相同
C.由状态B到状态C,可以用加热的方法
D.A、C两点混合气体的平均相对分子质量:C>A
AD
解析试题分析:由已知反应方程式可知,反应的正反应是吸热反应,所以温度升高平衡正向移动,NO2的体积分数增大,根据图像,压强相同时,A、B两点的NO2的体积分数A点更大,则说明温度T2>T1,温度越大反应速率越大,所以A正确;B、C两点的温度不同,所以平衡常数不相等,B错误;状态B和状态C不仅温度不同,压强也不同,所以仅通过加热方法不能实现状态B到状态C的转变,C错误;C相对于A增大了压强,压强增大平衡逆向移动,则气体的物质的量减小,气体总质量不变,所以平均相对分子质量增大,D正确;故选AD。
考点:本题考查的是根据图像来判断影响平衡的因素。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案一定温度下,将1molA(g)和1molB(g)充入2L密闭容器中发生反应,在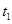 时达平衡:
时达平衡: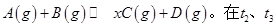 时刻分别改变反应的一个条件,测得溶器中C(g)的浓度随时间变化如图所示。有关说法正确的是
时刻分别改变反应的一个条件,测得溶器中C(g)的浓度随时间变化如图所示。有关说法正确的是
A.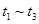 间该反应的平衡常数相同,均为0.25 间该反应的平衡常数相同,均为0.25 |
B. 时刻改变的条件是使用催化剂 时刻改变的条件是使用催化剂 |
C. 时刻改变的条件是移去少量D 时刻改变的条件是移去少量D |
| D.反应方程式中x=2 |
将NO2装入带活塞的密闭容器中,当反应2NO2(g) N2O4(g)达到平衡后,改变下列一个条件,其中叙述正确的是()
N2O4(g)达到平衡后,改变下列一个条件,其中叙述正确的是()
| A.升高温度,气体颜色加深,则此反应为吸热反应 |
| B.慢慢压缩气体体积,平衡向右移动,混合气体颜色变浅 |
| C.慢慢压缩气体体积,若体积减小一半,压强增大,但小于原来的两倍 |
| D.恒温恒容时,充入少量惰性气体,压强增大,平衡向右移动,混合气体的颜色变浅 |
在一定条件下,对于A2(g)+3B2(g) 2AB3(g)反应来说,以下化学反应速率的表示中,化学反应速率最快的是
2AB3(g)反应来说,以下化学反应速率的表示中,化学反应速率最快的是
| A.v(A2)=0.8 mol·L-1·s-1 | B.v(A2)=30 mol·L-1·min-1 |
| C.v(AB3)=1.0 mol·L-1·s-1 | D.v(B2)=1.2 mol·L-1·s-1 |
一定条件下,可逆反应C(s)+CO2(g) 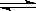 2CO(g) ΔH<0,达到平衡状态,现进行如下操作:①升高反应体系的温度;②增加反应物C的用量;③缩小反应体系的体积:④减少体系中CO的量。上述措施中一定能使反应的正反应速率显著加快的是
2CO(g) ΔH<0,达到平衡状态,现进行如下操作:①升高反应体系的温度;②增加反应物C的用量;③缩小反应体系的体积:④减少体系中CO的量。上述措施中一定能使反应的正反应速率显著加快的是
| A.①②③④ | B.①③ | C.②④ | D.①③④ |
恒温条件下,对于可逆反应A(g)+B(g) C(g)+D(g),加入起始浓度相近的A和B,在达到平衡的过程中可能有三种情况,如下图所示。下列判断中正确的是
C(g)+D(g),加入起始浓度相近的A和B,在达到平衡的过程中可能有三种情况,如下图所示。下列判断中正确的是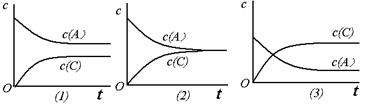
| A.(1)的K<1 | B.(2)的K≈1 | C.(3)的K>1 | D.以上三种可能全对 |
下列表述与示意图相符的是
| A.正反应为吸热反应 |
| B.升高温度,有利于反应向正方向进行 |
| C.A点时,反应向逆反应方向移动 |
| D.K正与K逆的关系是:K正=1/K逆 |
以下实验原理中,不能用勒沙特列原理解释的是
| A.实验室用排饱和食盐水的方法收集氯气 |
| B.用浓磷酸与KBr反应制备HBr气体 |
| C.配制FeSO4溶液时,加入一些铁粉 |
| D.在干燥的HCl气流里加热MgCl2·6H2O晶体,得到无水MgCl2 |
 xC(g) △H < 0,B、C的物质的量随时间变化的关系如图所示。下列有关说法不正确的是
xC(g) △H < 0,B、C的物质的量随时间变化的关系如图所示。下列有关说法不正确的是