题目内容
【题目】一些资料认为NO不能与Na2O2反应,某同学提出质疑,他认为NO易与O2发生反应,应该更容易被Na2O2氧化。査阅资料:
a.2NO+Na2O2=2NaNO2;
b.6NaNO2+3H2SO4(稀)=3Na2SO4+2HNO3+4NO↑+2H2O;
某同学用如图所示装置(部分夹持装置略),探究NO与Na2O2的反应。
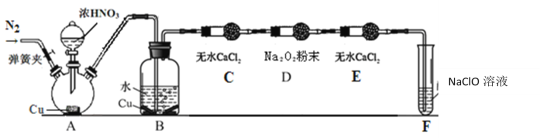
(1)请写出A中反应的化学方程式___。
(2)B中观察到的主要现象是___。
(3)在反应前,打开弹簧夹,通入一段时间N2,目的是___。
(4)充分反应后,检验D装置中发生反应的实验是___。
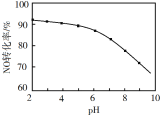
(5)NO的氧化吸收。用NaClO溶液吸收硝酸尾气,可提高尾气中NO的去除率。其他条件相同,NO转化为NO![]() 的转化率随NaClO溶液初始pH(用稀盐酸调节)的变化如图所示:
的转化率随NaClO溶液初始pH(用稀盐酸调节)的变化如图所示:
①在酸性NaClO溶液中,HClO氧化NO生成Cl-和NO![]() ,其离子方程式为___,若标准状况下16.8LNO被NaClO溶液完全吸收,则转移的电子的物质的量为___mol。
,其离子方程式为___,若标准状况下16.8LNO被NaClO溶液完全吸收,则转移的电子的物质的量为___mol。
②NaClO溶液的初始pH越小,NO转化率越高。其原因是___。
【答案】Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+4H2O 铜片逐渐溶解,溶液变为蓝色,有无色气泡产生 排尽装置中的空气 取D装置中的产物少量于试管中,然后加稀硫酸,若产生无色气体,无色气体遇到空气变为红棕色,则产物为NaNO2 2NO+3HClO+H2O=2![]() +3Cl-+5H+ 2.25 NaClO初始pH越小,c(H+)越大,HClO浓度越大,氧化NO的能力越强
+3Cl-+5H+ 2.25 NaClO初始pH越小,c(H+)越大,HClO浓度越大,氧化NO的能力越强
【解析】
实验目的是探究NO与Na2O2的反应,根据所给装置图,装置A制备NO2,装置B是制备NO,装置C为干燥装置,装置D为反应装置,装置E防止F中水蒸气进入D,F装置为尾气处理装置,据此分析;
(1)装置A的作用是制备NO2,反应方程式为Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+4H2O;
(2)装置B中发生的反应有3NO2+H2O=2HNO3+NO,3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O,装置B中观察到的现象是铜片逐渐溶解,溶液变为蓝色,有无色气泡产生;
(3)空气中的氧气能与NO反应,实验前要排尽,通入N2的作用是排尽装置中的空气;
(4)根据信息,装置D中产物是NaNO2,NaNO2与稀硫酸发生反应生成NO,因此要检验NaNO2:取D装置中的产物少量于试管中,然后加稀硫酸,若产生无色气体,无色气体遇到空气变为红棕色,则产物为NaNO2;
(5)①HClO作氧化剂,被还原为Cl-,NO被氧化成![]() ,根据得失电子数目守恒,以及原子守恒、电荷守恒,其离子方程式为2NO+3HClO+H2O=2
,根据得失电子数目守恒,以及原子守恒、电荷守恒,其离子方程式为2NO+3HClO+H2O=2![]() +3Cl-+5H+;NO中+2价N被氧化成+5价,因此标况下16.8LNO被氧化,转移电子物质的量为
+3Cl-+5H+;NO中+2价N被氧化成+5价,因此标况下16.8LNO被氧化,转移电子物质的量为![]() =2.25mol;
=2.25mol;
②NaClO初始pH越小,c(H+)越大,HClO浓度越大,氧化性越强。

 中考解读考点精练系列答案
中考解读考点精练系列答案 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案【题目】某小组同学通过实验研究FeCl3溶液与Cu粉发生的氧化还原反应。实验记录如下表所示,下列说法错误的是
序号 | Ⅰ | Ⅱ | Ⅲ |
实验步骤 |
充分振荡,加入2mL蒸馏水 |
充分振荡,加入2mL蒸馏水 |
充分振荡,加入2mL蒸馏水 |
实验现象 | 铜粉消失,溶液黄色变浅,加入蒸馏水后无明显现象 | 铜粉有剩余,溶液黄色褪去,加入蒸馏水后生成白色沉淀 | 铜粉有利余、溶液黄色褪去,变成蓝色,加入蒸馏水后无白色沉淀 |
A.实验Ⅰ、Ⅱ、Ⅲ中均涉及Fe3+被还原
B.对比实验Ⅰ、Ⅱ、Ⅲ说明白色沉淀的产生可能与铜粉的量及溶液的阴离子种类有关
C.向实验Ⅲ反应后的溶液中加入饱和NaCl溶液可能出现白色沉淀
D.实验Ⅱ、Ⅲ中加入蒸溜水后c(Cu2+)相同