题目内容
“温室效应”是全球关注的环境问题之一.CO2是目前大气中含量最高的一种温室气体.因此,控制和治理CO2是解决温室效应的有效途径.
(1)下列措施中,有利于降低大气中CO2浓度的有: .(填字母)
a.减少化石燃料的使用 b.植树造林,增大植被面积
c.采用节能技术 d.利用太阳能、风能
(2)将CO2转化成有机物可有效实现碳循环.CO2转化成有机物的例子很多,如:
a.6CO2+6H2O
C6H12O6+6O2 b.CO2+3H2
CH3OH+H2O
c.CO2+CH4
CH3COOH d.2CO2+6H2
CH2═CH2+4H2O
以上反应中,最节能的是 ,原子利用率最高的是 .(填字母)
(3)文献报道某课题组利用CO2催化氢化制甲烷的研究过程如下:
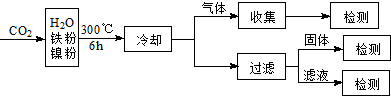
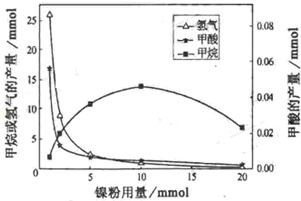
反应结束后,气体中检测到CH4和H2,滤液中检测到HCOOH,固体中检测到镍粉和Fe3O4.CH4、HCOOH、H2的产量和镍粉用量的关系如图所示(仅改变镍粉用量,其他条件不变):
研究人员根据实验结果得出结论:HCOOH是CO2转化为CH4的中间体,
即:CO2
HCOOH
CH4
①写出产生H2的反应方程式 .
②由图可知,镍粉是 .(填字母)
a.反应Ⅰ的催化剂
b.反应Ⅱ的催化剂
c.反应Ⅰ、Ⅱ的催化剂
d.不是催化剂
③当镍粉用量从1mmol增加到10mmol,反应速率的变化情况是 .(填字母)
a.反应Ⅰ的速率增加,反应Ⅱ的速率不变
b.反应Ⅰ的速率不变,反应Ⅱ的速率增加
c.反应Ⅰ、Ⅱ的速率均不变
d.反应Ⅰ、Ⅱ的速率均增加,且反应Ⅰ的速率增加得快
e.反应Ⅰ、Ⅱ的速率均增加,且反应Ⅱ的速率增加得快
f.反应Ⅰ的速率减小,反应Ⅱ的速率增加.
(1)下列措施中,有利于降低大气中CO2浓度的有:
a.减少化石燃料的使用 b.植树造林,增大植被面积
c.采用节能技术 d.利用太阳能、风能
(2)将CO2转化成有机物可有效实现碳循环.CO2转化成有机物的例子很多,如:
a.6CO2+6H2O
| 光合作用 |
| 催化剂 |
| △ |
c.CO2+CH4
| 催化剂 |
| △ |
| 催化剂 |
| △ |
以上反应中,最节能的是
(3)文献报道某课题组利用CO2催化氢化制甲烷的研究过程如下:

反应结束后,气体中检测到CH4和H2,滤液中检测到HCOOH,固体中检测到镍粉和Fe3O4.CH4、HCOOH、H2的产量和镍粉用量的关系如图所示(仅改变镍粉用量,其他条件不变):

研究人员根据实验结果得出结论:HCOOH是CO2转化为CH4的中间体,
即:CO2
| Ⅰ |
| Ⅱ |
①写出产生H2的反应方程式
②由图可知,镍粉是
a.反应Ⅰ的催化剂
b.反应Ⅱ的催化剂
c.反应Ⅰ、Ⅱ的催化剂
d.不是催化剂
③当镍粉用量从1mmol增加到10mmol,反应速率的变化情况是
a.反应Ⅰ的速率增加,反应Ⅱ的速率不变
b.反应Ⅰ的速率不变,反应Ⅱ的速率增加
c.反应Ⅰ、Ⅱ的速率均不变
d.反应Ⅰ、Ⅱ的速率均增加,且反应Ⅰ的速率增加得快
e.反应Ⅰ、Ⅱ的速率均增加,且反应Ⅱ的速率增加得快
f.反应Ⅰ的速率减小,反应Ⅱ的速率增加.
分析:(1)降低大气中CO2浓度,应减少化石能源的使用,提倡使用清洁能源;
(2)最节能的措施应使用太阳能;原子利用率最高,应使反应物尽可能转化为生成物,使原子利用率达到100%;
(3)①反应物中含有铁粉和水,在高温条件下可生成氢气;
②Ni为有机反应中常用的加氢催化剂之一,反应I、II均为加氢反应,故加入Ni粉会使反应ⅠⅡ的速率均增加,在图中表现为CH4的生成速率和H2的消耗速率均增大;
③从图中可见随着镍粉用量从1 mmol增加到10 mmol,甲酸的产量在迅速减少,说明甲酸的消耗速率大于其生成速率,因此说明反应Ⅱ的速率要比反应Ⅰ的速率增加得快.
(2)最节能的措施应使用太阳能;原子利用率最高,应使反应物尽可能转化为生成物,使原子利用率达到100%;
(3)①反应物中含有铁粉和水,在高温条件下可生成氢气;
②Ni为有机反应中常用的加氢催化剂之一,反应I、II均为加氢反应,故加入Ni粉会使反应ⅠⅡ的速率均增加,在图中表现为CH4的生成速率和H2的消耗速率均增大;
③从图中可见随着镍粉用量从1 mmol增加到10 mmol,甲酸的产量在迅速减少,说明甲酸的消耗速率大于其生成速率,因此说明反应Ⅱ的速率要比反应Ⅰ的速率增加得快.
解答:解:(1)a.减少化石燃料的使用,可减少二氧化碳的排放,故a正确;
b.植树造林,增大植被面积,通过光合作用,可降低二氧化碳浓度,故b正确;
c.采用节能技术,可减少化石能源的消耗,减少二氧化碳的排放,故c正确;
d.利用太阳能、风能,可减少化石能源的使用,减少二氧化碳的排放,故d正确,
故答案为:abcd;
(2)最节能的措施应使用太阳能,原子利用率等于期望产物的总质量与生成物的总质量之比,只有反应c的原子利用率为100%,反应a的生成物中除期望产物(葡萄糖)外还有氧气产生,
故答案为:a;c;
(3)①铁粉与水蒸气在加热条件下生成Fe3O4和氢气,生成的氢气将和CO2反应产生甲酸,进一步和甲酸反应产生甲烷,
反应的方程式为3Fe+4H2O
Fe3O4+4H2,
故答案为:3Fe+4H2O
Fe3O4+4H2;
②由于反应是在固定时间内完成,之后进行冷却和物质检验,因此检验得到的物质产量(mmol)即可以代表化学反应的平均速率,Ni为有机反应中常用的加氢催化剂之一,反应I、II均为加氢反应,故加入Ni粉会使反应ⅠⅡ的速率均增加,在图中表现为CH4的生成速率和H2的消耗速率均增大,
故答案为:c;
③从图中可见随着镍粉用量从1 mmol增加到10 mmol,甲酸的产量在迅速减少,说明甲酸的消耗速率大于其生成速率,因此说明反应Ⅱ的速率要比反应Ⅰ的速率增加得快,
故答案为:e.
b.植树造林,增大植被面积,通过光合作用,可降低二氧化碳浓度,故b正确;
c.采用节能技术,可减少化石能源的消耗,减少二氧化碳的排放,故c正确;
d.利用太阳能、风能,可减少化石能源的使用,减少二氧化碳的排放,故d正确,
故答案为:abcd;
(2)最节能的措施应使用太阳能,原子利用率等于期望产物的总质量与生成物的总质量之比,只有反应c的原子利用率为100%,反应a的生成物中除期望产物(葡萄糖)外还有氧气产生,
故答案为:a;c;
(3)①铁粉与水蒸气在加热条件下生成Fe3O4和氢气,生成的氢气将和CO2反应产生甲酸,进一步和甲酸反应产生甲烷,
反应的方程式为3Fe+4H2O
| ||
故答案为:3Fe+4H2O
| ||
②由于反应是在固定时间内完成,之后进行冷却和物质检验,因此检验得到的物质产量(mmol)即可以代表化学反应的平均速率,Ni为有机反应中常用的加氢催化剂之一,反应I、II均为加氢反应,故加入Ni粉会使反应ⅠⅡ的速率均增加,在图中表现为CH4的生成速率和H2的消耗速率均增大,
故答案为:c;
③从图中可见随着镍粉用量从1 mmol增加到10 mmol,甲酸的产量在迅速减少,说明甲酸的消耗速率大于其生成速率,因此说明反应Ⅱ的速率要比反应Ⅰ的速率增加得快,
故答案为:e.
点评:本题为08年江苏高考题.此题从生活的热点问题出发,探讨了能源的循环利用和温室效应的解决,着重考查了物质催化反应的过程,结合考查了化学反应速率和对图表的理解解析能力,综合能力要求较高.另外读图时要注意观察横纵坐标的含义和单位.

练习册系列答案
 同步练习强化拓展系列答案
同步练习强化拓展系列答案
相关题目
 zxxk.com
zxxk.com

 研究人员根据实验结果得出结论:
研究人员根据实验结果得出结论: