题目内容
10.现将1mol Cu2S与2mol FeO投入到足量稀硝酸溶液中,充分反应得到Fe(NO3)3、Cu(NO3)2、CuSO4的混合溶液,并产生NO气体.则最终反应所得NO物质的量为( )| A. | 4mol | B. | 5mol | C. | 6mol | D. | 7mol |
分析 反应中Cu元素化合价由+1价升高为+2价,S元素化合价由-2升高为+6,Fe元素化合价由+2升高为+3,而N元素化合价由+5降低为+2,根据电子转移守恒计算生成NO的物质的量.
解答 解:将1mol Cu2S与2mol FeO投入到足量稀硝酸溶液中,反应中Cu元素化合价由+1价升高为+2价,S元素化合价由-2升高为+6,Fe元素化合价由+2升高为+3,而N元素化合价由+5降低为+2,
根据电子转移守恒可得:(5-2)×n(NO)=1mol×[2×(2-1)+6-(-2)]+2mol×(3-2),
解得:n(NO)=4mol
故选A.
点评 本题考查了混合物反应的计算、氧化还原反应的计算,题目难度中等,明确发生反应的实质为解答关键,注意掌握电荷守恒在氧化还原反应的计算中的应用方法,试题培养了学生的化学计算能力.

练习册系列答案
相关题目
20.下列物质均有漂白作用,其漂白原理相同的是( )
①二氧化硫
②次氯酸
③过氧化钠
④活性炭
⑤臭氧
⑥过氧化氢.
①二氧化硫
②次氯酸
③过氧化钠
④活性炭
⑤臭氧
⑥过氧化氢.
| A. | ①②⑤⑥ | B. | ①②③④ | C. | ②③⑤⑥ | D. | ①④ |
1.下列离子方程式不正确的是( )
| A. | 用过量的氨水吸收二氧化硫:2NH3•H2O+SO2═2NH4++SO${\;}_{3}^{2-}$?+H2O | |
| B. | Al(OH)3沉淀中滴加盐酸 Al(OH)3+3H+═Al3++3H2O | |
| C. | AlCl3溶液中加入过量氨水:Al3++4OH-═AlO2-+2H2O | |
| D. | 碳酸氢钠溶液中滴加氢氧化钠:HCO3-+OH-═CO32-+H2O |
5.下列物质符合如图阴影部分的要求,且其在水溶液中的电离方程式书写正确的是( )
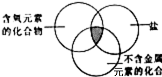

| A. | K2CO3═2K++CO32- | B. | NH4NO3═NH4++NO3- | ||
| C. | H2SO4═2H++SO42- | D. | NH4ClO3═NH4++Cl5++3O2- |
2.下列离子组中,在由水电离出的c(H+)•c(0H-)=1×10-26mol•L-1的溶液中一定能大量共存的是( )
| A. | Na+、Mg2+、Al3+、Cl- | B. | Na+、K+、Cl-、SO42- | ||
| C. | HCO3-、Na+、Cl-、K+ | D. | I-、Fe2+、Na+、NO3- |
19.已知某二元酸H2A溶于水发生电离:H2A=H++HA-;HA-?H++A2-,则酸式盐MHA溶于水电离出的离子中,一定不能发生水解的是( )
| A. | M+ | B. | HA- | C. | A2- | D. | M+和HA- |
 氮及其化合物在生产、生活中有极其重要的作用.
氮及其化合物在生产、生活中有极其重要的作用.