题目内容
【题目】把3.06g铝和镁的混合物粉末放入100mL盐酸中,恰好完全反应,并得到标准状况下3.36LH2 . 计算:
(1)该合金中铝的物质的量;
(2)该合金中镁的质量;
(3)反应后溶液中Cl﹣的物质的量浓度(假定反应体积仍为100mL).(要有过程)
【答案】
(1)解:标准状况下3.36L氢气的物质的量为: ![]() =0.15mol,
=0.15mol,
设3.06g金属的混合物中含有Al和Mg的物质的量分别为x、y,
则: 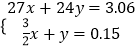 ,
,
解得: ![]() ,
,
则该合金中铝的物质的量为0.06mol,
答:合金中铝的物质的量0.06 mol;
(2)解:根据(1)可知,该合金中含有0.06mol镁,含有镁的质量为:24g/mol×0.06mol=1.44 g,答:该合金中含有Mg的质量为1.44g;
(3)解:合金与盐酸恰好完全反应,反应后溶质为氯化铝和氯化镁,则反应后溶液中含有氯离子的总物质的量为:0.06mol×2+0.06mol×3=0.3mol,所以反应后溶液中氯离子的浓度为: ![]() =3.0mol/L,答:反应后溶液中Cl﹣的物质的量浓度为3.0 mol/L.
=3.0mol/L,答:反应后溶液中Cl﹣的物质的量浓度为3.0 mol/L.
【解析】(1)根据n= ![]() 计算出生成氢气的物质的量,设出铝和镁的物质的量,分别根据质量和生成氢气的量列式计算;(2)根据m=nM计算出该合金中Mg的质量;(3)反应后溶质为氯化镁和氯化铝,根据质量守恒计算出氯离子的物质的量,再根据n=
计算出生成氢气的物质的量,设出铝和镁的物质的量,分别根据质量和生成氢气的量列式计算;(2)根据m=nM计算出该合金中Mg的质量;(3)反应后溶质为氯化镁和氯化铝,根据质量守恒计算出氯离子的物质的量,再根据n= ![]() 计算出氯离子的浓度.
计算出氯离子的浓度.

练习册系列答案
相关题目