题目内容
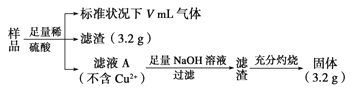
【题目】部分氧化的FeCu合金样品(氧化产物为Fe2O3、CuO)共5.76g,经如下处理:下列说法正确的是( )
A.滤液A中的阳离子为Fe2+、Fe3+、H+
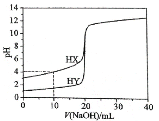
B.样品中CuO的质量为4.0g
C.V=448
D.原样品中Fe元素的质量分数为41%
【答案】C
【解析】
试题分析:硫酸足量、滤液A不含Cu2+,可知加入硫酸后的3.2g滤渣全是铜;加入氢氧化钠后的滤渣、灼烧后得固体是氧化铁共3.2g。所以原合金中铜元素3.2g、铁元素![]() ;合金样品氧元素的质量是5.76g-3.2g-2.24g=0.32g。有铜析出,所以滤液中不可能含有Fe3+,故A错误;铜元素+氧元素=3.52g,,所以CuO的质量不可能为4.0g,故B错误;反应后生成硫酸亚铁的物质的量是
;合金样品氧元素的质量是5.76g-3.2g-2.24g=0.32g。有铜析出,所以滤液中不可能含有Fe3+,故A错误;铜元素+氧元素=3.52g,,所以CuO的质量不可能为4.0g,故B错误;反应后生成硫酸亚铁的物质的量是![]() 0.04mol;所以参加反应的硫酸0.04mol,反应生成水
0.04mol;所以参加反应的硫酸0.04mol,反应生成水![]() 0.02mol;所以生成氢气0.04mol-0.02mol=0.02mol,标准状况下的体积是448mL,故C正确;原样品中Fe元素的质量分数为
0.02mol;所以生成氢气0.04mol-0.02mol=0.02mol,标准状况下的体积是448mL,故C正确;原样品中Fe元素的质量分数为![]() 38.9%,故D错误。
38.9%,故D错误。

练习册系列答案
相关题目