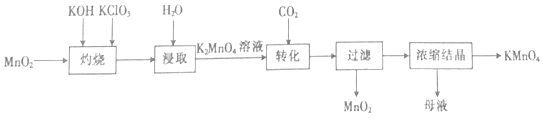
题目内容
【题目】图甲表示的是H2O2分解反应过程中的能量变化.在不同温度下,分别向H2O2溶液(20gL﹣1)中加入相同体积且物质的量浓度均为0.5molL﹣1的不同溶液,反应中H2O2浓度随时间的变化如图乙所示.从图中得出的结论不正确的是( ) 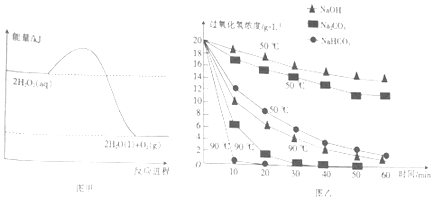
A.H2O2的分解反应为放热反应
B.断裂共价键所需的能量:2×E(O﹣O)<1×E(O=O)
C.加入相同物质时,温度越高,H2O2分解的速率越快
D.相同温度下,加入不同物质的溶液,碱性越强,H2O2分解的速率越快
【答案】D
【解析】解:A.由图形可知,反应物总能量大于生成物总能量,则为放热反应,故A正确;B.H2O2分解反应属于放热反应,注意断裂化学键吸收能量,形成化学键放出能量,反应物、生成物含有相同的O﹣H,则2×E(O﹣O)<1×E(O=O),故B正确;
C.升高温度,可加快反应速率,故C正确;
D.由图象可知在90℃时一定时间之内,碳酸氢钠的斜率较大,则反应较快,故D错误;
故选D.
【考点精析】通过灵活运用反应热和焓变,掌握在化学反应中放出或吸收的热量,通常叫反应热即可以解答此题.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目