题目内容
【题目】三氯化硼的熔点为﹣107.3℃,沸点为12.5℃,易水解生成硼酸和氯化氢,可用于制造高纯硼、有机合成催化剂等.实验室制取三氯化硼的原理为:B2O3+3C+3Cl2 ![]() 2BCl3+3CO
2BCl3+3CO
(1)甲组同学拟用下列装置制取纯净干燥的氯气(不用收集). 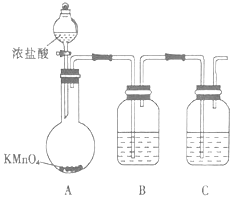
①装置B中盛放的试剂是 , 装置C的作用是 .
②装置A中发生反应的离子方程式为 .
(2)乙组同学选用甲组实验中的装置A、B、C和下列装置(装置可重复使用)制取BCl3并验证反应中有CO生成. 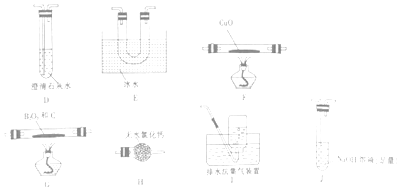
①乙组同学的实验装置中,依次连接的合理顺序为A→B→C→→→→→→F→D→I.
②实验开始时,先通入干燥N2的目的是 .
③能证明反应中有CO生成的现象是 .
【答案】
(1)饱和食盐水;干燥氯气;2MnO4﹣+16H++10Cl﹣=2Mn2++5Cl2↑+8H2O
(2)G;E;H;J;H;排除装置中的空气;装置F中黑色粉末变为红色,装置D中澄清石灰水变浑浊
【解析】解:(1)根据实验装置图可知,用高锰酸钾与浓盐酸反应制得氯气,同时生成氯化钾和氯化锰,制得的氯气中含有氯化氢和水杂质,要用饱和食盐水除去氯化氢,用浓硫酸除去水份,而得到干燥纯净的氯气,①根据上面的分析可知,装置B中盛放的试剂是饱和食盐水,装置C中装有浓硫酸,其作用是干燥氯气,所以答案是:饱和食盐水;干燥氯气;②装置A中高锰酸钾与浓盐酸反应制得氯气,同时生成氯化钾和氯化锰,发生反应的离子方程式为 2MnO4﹣+16H++10Cl﹣=2Mn2++5Cl2↑+8H2O,
所以答案是:2MnO4﹣+16H++10Cl﹣=2Mn2++5Cl2↑+8H2O;(2)乙组同学选用甲组实验中的装置A、B、C制得干燥的氯气,用氯气与B2O3、C反应生成三氯化硼和CO,三氯化硼的熔点为﹣107.3℃,沸点为12.5℃,所以收集三氯化硼要用冰水冷却,未反应的氯气尾气用氢氧化钠吸收,三氯化硼易水解,为防止氢氧化钠溶液中水进入装置E,在E和J之间接上H装置,用于吸水,生成的CO经干燥后再通过F装置还原氧化铜,再将生成的气体通过澄清石灰水检验,可以证明原反应中有一氧化碳生成,多余的CO不能排放到空气中,要用排水法收集,①根据上面的分析可知,乙组同学的实验装置中,依次连接的合理顺序为A→B→C→G→E→H→J→H→F→D→I,
所以答案是:G、E、H、J、H;②三氯化硼易水解,在实验开始时,要将装置中的空气排尽,所以要先通入干燥N2 ,
所以答案是:排除装置中的空气;③根据实验的原理可知,生成的CO能将黑色的氧化铜还原为红色的铜,同时产生能使澄清石灰水变浑的气体,所以能证明反应中有CO生成的现象是装置F中黑色粉末变为红色,装置D中澄清石灰水变浑浊,
所以答案是:装置F中黑色粉末变为红色,装置D中澄清石灰水变浑浊.

 出彩同步大试卷系列答案
出彩同步大试卷系列答案