题目内容
【题目】下图是元素周期表的一部分,根据① ~ ⑧在周期表中的位置按题目要求回答:
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
二 | ① | ② | ③ | |||||
三 | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
(1)元素① ~ ⑧中,化学性质最不活泼元素的原子结构示意图是___________。除⑧外,原子半径最大的是_______(填元素符号),元素⑦的氢化物的电子式是_____。
(2)①②③三种元素的气态氢化物的稳定性由强到弱的顺序是______(用相应氢化物的化学式作答)。元素①~⑧中的最高价氧化物对应的水化物中呈两性的氢氧化物是____________(填化学式),它与元素④的最高价氧化物对应的水化物的溶液反应的离子方程式是_________________________________________________________。
(3)某同学设计并进行实验,探究元素④⑤⑥金属性递变规律,请将实验报告补充完整。
实验步骤 | 实验现象 |
1.将一小块④的单质放入滴有酚酞溶液的冷水中 | _______________________________,发出嘶嘶响声,逐渐消失,溶液变成红色 |
2.将少量冷水注入盛有打磨过的⑤的单质的试管中,再滴加酚酞,一段时间后加热至沸腾 | 加热后________________ |
3.将2 mL 1 mol/L盐酸加入盛有打磨过的⑤的单质的试管中 | 剧烈反应,迅速产生大量无色气泡 |
4.将2 mL 1 mol/L盐酸加入盛有打磨过的______的试管中 | 反应缓慢,一段时间后,产生无色气泡 |
结论:Na、Mg、Al三种元素的金属性依次减弱 | |
【答案】 Ar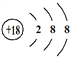 Na
Na ![]() HF > NH3 > CH4 Al(OH)3 Al(OH)3 + OH—= AlO2—+ 2H2O 钠浮在水面上,熔成小球,四处游动 镁条表面产生无色气泡,溶液呈红色 铝片
HF > NH3 > CH4 Al(OH)3 Al(OH)3 + OH—= AlO2—+ 2H2O 钠浮在水面上,熔成小球,四处游动 镁条表面产生无色气泡,溶液呈红色 铝片
【解析】根据元素在周期表中的位置可知①~⑧元素分别是C、N、F、Na、Mg、Al、Cl、Ar。(1)元素① ~ ⑧中,化学性质最不活泼元素Ar元素的原子结构示意图是: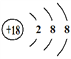 ;同周期元素原子从左到右逐渐减小,同主族元素从上而下原子半径逐渐增大,故除⑧外,原子半径最大的是Na;元素⑦是氯元素,其氢化物的电子式是:
;同周期元素原子从左到右逐渐减小,同主族元素从上而下原子半径逐渐增大,故除⑧外,原子半径最大的是Na;元素⑦是氯元素,其氢化物的电子式是:![]() ;(2)C、N、F三种元素的气态氢化物的稳定性由强到弱的顺序是:HF > NH3 > CH4;元素①~⑧中的最高价氧化物对应的水化物中呈两性的氢氧化物是Al(OH)3;它与元素Na的最高价氧化物对应的水化物NaOH溶液反应的离子方程式是: Al(OH)3 + OH—= AlO2—+ 2H2O ;(3)1.钠与水反应生成氢氧化钠与氢气,钠的密度小于水,熔点较低,钠浮在水面上,熔成小球,四处游动,发出嘶嘶响声,逐渐消失,溶液变成红色;2.镁和滴有酚酞的沸水反应生成氢氧化镁和氢气,氢氧化镁在水中能电离出氢氧根离子使溶液呈碱性,但氢氧化镁的溶解性很小,溶液呈浅红色;4.实验探究元素④⑤⑥金属性递变规律,故应是Al与盐酸反应;由金属与、水及酸的反应剧烈程度可知,Na、Mg、Al三种元素的金属性依次减弱。
;(2)C、N、F三种元素的气态氢化物的稳定性由强到弱的顺序是:HF > NH3 > CH4;元素①~⑧中的最高价氧化物对应的水化物中呈两性的氢氧化物是Al(OH)3;它与元素Na的最高价氧化物对应的水化物NaOH溶液反应的离子方程式是: Al(OH)3 + OH—= AlO2—+ 2H2O ;(3)1.钠与水反应生成氢氧化钠与氢气,钠的密度小于水,熔点较低,钠浮在水面上,熔成小球,四处游动,发出嘶嘶响声,逐渐消失,溶液变成红色;2.镁和滴有酚酞的沸水反应生成氢氧化镁和氢气,氢氧化镁在水中能电离出氢氧根离子使溶液呈碱性,但氢氧化镁的溶解性很小,溶液呈浅红色;4.实验探究元素④⑤⑥金属性递变规律,故应是Al与盐酸反应;由金属与、水及酸的反应剧烈程度可知,Na、Mg、Al三种元素的金属性依次减弱。

【题目】阅读下表中短周期主族元素的相关信息。
元素代号 | 相关信息 |
A | A的单质能与冷水剧烈反应,得到强碱性溶液 |
B | B元素为地壳中含量最多的元素 |
C | 在第三周期元素中,C形成的简单离子半径最小 |
D | A、B、D组成的36电子的化合物X是家用消毒剂的主要成分 |
E | 所有有机物中都含有E元素 |
请回答:
(1)C的简单离子的结构示意图:__________;
(2)X的化学式为__________;
(3)A、B、C三种元素形成的简单离子的半径由大到小的顺序为___________(用离子符号表示);
(4)EB2分子的电子式为:_________________________________。