题目内容
15.某恒温密闭容器中,可逆反应A(s)?B+C(g)-Q达到平衡.缩小容器体积,重新达到平衡时,C(g)的浓度与缩小体积前的平衡浓度相等.以下分析正确的是( )| A. | 若开始时向容器中加入1molB和1molC,达到平衡时放出热量Q | |
| B. | 平衡时,单位时间内n(A)消耗﹕n(C)消耗=2﹕1 | |
| C. | 保持体积不变,向平衡体系中加入B,平衡可能向逆反应方向移动 | |
| D. | 产物B的状态只能为固态或液态 |
分析 A、因反应为可逆反应,故加入1molB和1molC至反应达到平衡时不能完全消耗,放出热量小于Q;
B、平衡时,各物质的量不再改变,正反应速率和逆反应速率相等,因此单位时间内n(A)消耗=n(C)消耗;
C、保持体积不变,若B为气态,则向平衡体系中加入B,平衡逆向移动;
D、若B为气体,因容器保持恒温,缩小容器体积,达到新平衡时平衡常数不变,则气体C的浓度也一定不变.
解答 解:A、因反应为可逆反应,故加入1molB和1molC至反应达到平衡时转化率一定小于100%,因此放出热量小于Q,故A错误;
B、平衡时,各物质的量不再改变,正反应速率和逆反应速率相等,因此单位时间内n(A)消耗=n(C)消耗,故B错误;
C、若B是气体,平衡常数K=c(B)•c(C),若B是非气体,平衡常数K=c(C),由于C(g)的浓度不变,因此B可以是气体或是非气体,则B是气体,向平衡体系中加入B,平衡可能向逆反应方向移动,故C正确;
D、若B是气体,平衡常数K=c(B)•c(C),若B是非气体,平衡常数K=c(C),由于C(g)的浓度不变,因此B可以是气体或是非气体,故D错误;
故选C.
点评 本题考查化学平衡影响因素的分析判断,化学判断移动原理的理解为解题关键,题目难度中等.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
6.下列酒类,其中酒精含量最高的是( )
| A. | 啤酒 | B. | 白酒 | C. | 葡萄酒 | D. | 黄酒 |
3.如图所示,a、b是石墨电极,通电一段时间后,b极附近溶液显红色.下列说法正确的是( )
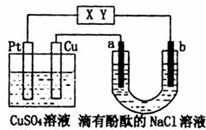

| A. | X极是电源负极,Y极是电源正极 | |
| B. | Pt极上有6.4gCu析出时,b极产生2.24L(标准状况)气体 | |
| C. | a极的电极反应式为:2C1--2e-═C12↑ | |
| D. | 电解过程中 CuSO4溶液的pH逐渐增大 |
10.在密闭容器中进行 X2(g)+4Y2(g)?2Z2(g)+3Q2(g) 的反应,其中X2、Y2、Z2、Q2的起始浓度分别为:0.1mol/L、0.4mol/L、0.2mol/L、0.3mol/L,反应达到平衡,各物质的浓度不可能为( )
| A. | c(X2)=0.15 mol/L | B. | c(Y2)=0.9 mol/L | C. | c(Z2)=0.3 mol/L | D. | c(Q2)=0.4 mol/L |
20.把9mL NO气体装入试管,倒立于水槽中,逐渐通入O2,当试管中剩余气体为3mL时,通入O2的体积可能是( )
| A. | 9 mL | B. | 6.75 mL | C. | 4.5 mL | D. | 3 mL |
7.已知Na2S2O3与H2SO4发生反应:Na2S2O3+H2SO4═Na2SO4+SO2↑+S↓+H2O,在相同温度下,下列化学反应速率最慢的是( )
| A. | 10mL 0.1mol/L Na2S2O3溶液和10mL 0.1mol/LH2SO4溶液 | |
| B. | 5mL 0.1mol/L Na2S2O3溶液和5mL 0.1mol/LH2SO4溶液 | |
| C. | 5mL 0.1mol/L Na2S2O3溶液和5mL 0.05mol/LH2SO4溶液 | |
| D. | 10mL 0.5mol/L Na2S2O3溶液和10mL 0.05mol/LH2SO4溶液 |
10.化学与生产、生活息息相关,下列叙述错误的是( )
| A. | 用聚乙烯塑料代替聚乳酸塑料可减少白色污染 | |
| B. | 含重金属离子的电镀废液不能随意排放 | |
| C. | 大量燃烧化石燃料是造成雾霾天气的一种重要因素 | |
| D. | Si3N4是一种新型无机非金属材料,可应用于制造发动机 |
11.下列物质中,属于天然高分子化合物的是( )
| A. | 脂肪 | B. | 纤维素 | C. | 氨基酸 | D. | 蔗糖 |