题目内容
将等物质的量的A.B混合于2L的密闭容器中,发生下列反应3A(g)+B(g) xC(g)+2D(g),经反应5min后,测知D的浓度为0.5mol/L,A.B的物质的量浓度之比为3∶5,C的平均反应速率是0.1mol/(L·min),试计算:
xC(g)+2D(g),经反应5min后,测知D的浓度为0.5mol/L,A.B的物质的量浓度之比为3∶5,C的平均反应速率是0.1mol/(L·min),试计算:
(1)x的值?
(2)5min内B的平均反应速率?
(3)5min时A的物质的量浓度?
【答案】
(1)2 (2)0.05mol·L-1·min-1 (3)0.75 mol·L-1
【解析】
试题分析:(1)C的平均反应速率是0.1mol/(L·min)
则生成物C的浓度是0.1mol/(L·min)×5min=0.5mol/L
所以x︰2=0.5︰0.5
解得x=2
(2)由于反应速率之比是相应的化学计量数之比
所以5min内B的平均反应速率是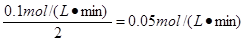
(3)设A和B的起始浓度都是x
根据反应的方程式可知,消耗A、B的浓度分别是
 、
、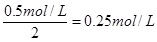
因此根据题意可知(x-0.75)︰(x-0.25)=3∶5
解得x=1.5mol/L
所以5min时A的物质的量浓度是1.5mol/L-0.75mol/L=0.75mol/L
考点:考查可逆反应的有关计算
点评:本题是中等难度的试题,也是高考中的常见题型。试题难易适中,注重基础和能力的双向考查,有利于培养学生的规范答题能力,特别是灵活运用知识解决实际问题的能力,有利于激发学生的学习积极性,提高学习效率。

练习册系列答案
 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案
相关题目
 cC+dD已知生成物C是固体,当反应进行一段时间后,测得A减少了n mol,B减少了n/2mol,C增加了3n/2mol,D增加了n mol,此时反应达到化学平衡.
cC+dD已知生成物C是固体,当反应进行一段时间后,测得A减少了n mol,B减少了n/2mol,C增加了3n/2mol,D增加了n mol,此时反应达到化学平衡. xC(g)+2D(g),经4min后测得D的浓度为0.5mol/L,
xC(g)+2D(g),经4min后测得D的浓度为0.5mol/L,