题目内容
【题目】用甲醇燃料电池作电源,用铁作电极电解含Cr2O72-的酸性废水,最终可将Cr2O72-转化成Cr(OH)3沉淀而除去,装置如下图。下列说法正确的是
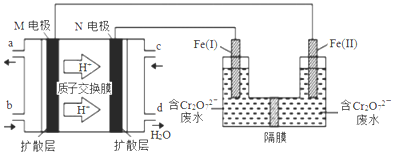
A. Fe(II)为阳极
B. M电极的电极反应式为CH3OH+8OH--6e-= CO32-+6H2O
C. 电解一段时间后,在Fe(Ⅰ)极附近有沉淀析出
D. 电路中每转移6mol电子,最多有1 mol Cr2O72-被还原
【答案】C
【解析】A. H+向右移动,表明M电极是负电极,Fe(II)为阴极,故A错误;B. 酸性溶液中没有大量OH-,M电极的电极反应式为CH3OH+H2O-6e-= CO2↑+6H+,故B错误;C. Fe(Ⅰ)产生Fe2+,6Fe2++Cr2O72-+14H+==6Fe3++2Cr3++7H2O,电解一段时间后,Fe(II)产生的OH-大量移向阳极区,在Fe(Ⅰ)极附近产生Fe(OH)3、Cr(OH)3沉淀析出,故C正确;D. 6Fe2+~Cr2O72-,电路中每转移6mol电子,最多有0.5mol Cr2O72-被还原,故D错误。故选C。

 七彩题卡口算应用一点通系列答案
七彩题卡口算应用一点通系列答案【题目】下列有关物质检验的实验结论正确的是
选项 | 实 验 操 作 及 现 象 | 实 验 结 论 |
A | 向某溶液中加入盐酸酸化的氯化钡溶液,有白色沉淀生成 | 该溶液中一定含有SO42- |
B | 向某溶液中加入2滴KSCN溶液,溶液不显红色。再向溶液中加入几滴新制的氯水,溶液变为红色 | 该溶液中一定含有 Fe2+ |
C | 将某气体通入品红溶液中,品红溶液褪色 | 该气体一定是SO2 |
D | 某钾盐溶于盐酸,产生能使澄清石灰水变浑浊的无色无味气体 | 该钾盐是K2CO3 |
A. A B. B C. C D. D
【答案】B
【解析】
白色沉淀可能为AgCl;产生的气体能使澄清石灰水变浑浊,气体为二氧化碳或二氧化硫;先加入硫氰化钾溶液,溶液不显示红色,说明溶液中不存在铁离子,再加入具有氧化性的氯水,溶液变成红色,说明原溶液中一定存在亚铁离子;能使品红褪色的气体不一定为SO2;产生的气体能使澄清石灰水变浑浊,气体为二氧化碳或二氧化硫。
白色沉淀也可能为AgCl,若先加盐酸排除干扰,不生成沉淀,再加氯化钡生成沉淀,则溶液中一定含有SO42-,A错误;向某溶液中加入2滴KSCN溶液,溶液不显红色,说明溶液中不存在铁离子;再向溶液中加入几滴新制的氯水,溶液变为红色,说明加入氯水后溶液中出现了铁离子,证明原溶液中一定含有Fe2+,B正确;能使品红褪色的气体不一定为SO2,也可能为其它强氧化性气体,如氯气、臭氧等,C错误;产生的气体能使澄清石灰水变浑浊,气体可能为二氧化碳或二氧化硫,则溶液中可能含有CO32-、HCO3-,或SO32-、HSO3-,D错误。
【点睛】
本题考查化学实验方案的评价,侧重分析与实验能力的考查,注意实验的评价性分析,把握常见离子的检验、物质的性质、气体的检验等为解答的关键。
【题型】单选题
【结束】
17
【题目】在铜与浓硫酸的反应中,如果转移0.4mol电子,则被还原的硫酸物质的量
A. 0.4mol B. 0.2mol
C. 小于0.4mol D. 小于0.2 mol