题目内容
16.某含镍(NiO)废料中有FeO、Al2O3、MgO、SiO2等杂质,用此废料提取NiSO4的工艺流程如图1:
已知:①有关金属离子生成氢氧化物沉淀所需的pH如图.
②25℃时,NH3•H2O的电离常数Kb=1.8×10-5.HF的电离常数Ka=7.2×10-4,Ksp (MgF2)=7.4×10-11.
(1)加Na2CO3调节溶液的pH至5,得到废渣2的主要成分是Al(OH)3、Fe(OH)3(填化学式).
(2)Mg能与饱和NH4Cl溶液反应产生NH3,请用化学平衡移动原理解释(用必要的文字和离子方程式回答)氯化铵水解生成盐酸和一水合氨,NH4++H2O?NH3•H2O+H+,镁和氢离子反应生成氢气,氢离子浓度减小,促进平衡正向进行,生成的一水合氨布恩分解生成氨气,Mg+2NH4+=Mg2++2NH3↑+H2↑.
(3)25℃时,1mol•L-1的NaF溶液中c(OH-)=$\frac{1{0}^{-14}}{7.2×1{0}^{-4}}$ mol•L-1(列出计算式即可).NH4F溶液呈酸性(填“酸性”、“碱性”或“中性”).
(4)已知沉淀前溶液中c(Mg2+)=1.85×10-3mol•L-1,当除镁率达到99%时,溶液中c(F-)=2.0×10-3 mol•L-1.
(5)在NaOH溶液中用NaClO与NiSO4反应可得NiO(OH),化学方程式为2NiSO4+NaClO+4NaOH=2Na2SO4+NaCl+2NiO(OH)+H2O
此空删去;NiO(OH)与贮氢的镧镍合金可组成镍氢碱性电池(KOH溶液),工作原理为:LaNi5H6+6NiO(OH)$?_{充电}^{放电}$LaNi5+6NiO+6H2O,负极的电极反应式:LaNi5H6+6OH--6e-=LaNi5+6H2O.
分析 某NiO的废料中有FeO、Al2O3、MgO、SiO2等杂质,加入稀硫酸溶解后过滤得到滤渣1为SiO2,滤液为NiSO4、FeSO4、Al2(SO4)3、MgSO4,加入过氧化氢氧化亚铁离子为铁离子,再加入碳酸钠溶液调节溶液PH,使铁离子,铝离子全部沉淀,过滤得到滤渣2为氢氧化铁和氢氧化铝沉淀,滤液中加入NH4F沉淀Mg2+,生成沉淀滤渣3为MgF2,过滤得到的滤液,滤液中获得NiSO4.6H2O晶体的方法是通过蒸发浓缩,冷却结晶,过滤洗涤,干燥得到晶体,失去结晶水得到硫酸镍,
(1)加入碳酸钠溶液调节溶液PH,使铁离子,铝离子全部沉淀;
(2)氯化铵溶液中铵根水解溶液显酸性,镁和氢离子反应生成氢气,促进反应正向进行生成的一水合氨分解生成氨气;
(3)25℃时,1mol•L-1的NaF溶液中c(F-)=1mol/L,结合电离平衡常数计算;一水合氨电离平衡常数数Kb=1.8×10-5.HF的电离常数Ka=7.2×10-4,HF电离程度大,对应离子水解程度小;
(4)已知沉淀前溶液中c(Mg2+)=1.85×10-3mol•L-1,当除镁率达到99%时,c(Mg2+)=1.85×10-5mol•L-1,结合溶度积常数计算;
(5)在NaOH溶液中用NaClO与NiSO4反应可得NiO(OH),同时生成硫酸钠和氯化钠.
解答 解:某NiO的废料中有FeO、Al2O3、MgO、SiO2等杂质,加入稀硫酸溶解后过滤得到滤渣1为SiO2,滤液为NiSO4、FeSO4、Al2(SO4)3、MgSO4,加入过氧化氢氧化亚铁离子为铁离子,再加入碳酸钠溶液调节溶液PH,使铁离子,铝离子全部沉淀,过滤得到滤渣2为氢氧化铁和氢氧化铝沉淀,滤液中加入NH4F沉淀Mg2+,生成沉淀滤渣3为MgF2,过滤得到的滤液,滤液中获得NiSO4.6H2O晶体的方法是通过蒸发浓缩,冷却结晶,过滤洗涤,干燥得到晶体,失去结晶水得到硫酸镍,
(1)加入碳酸钠溶液调节溶液PH,使铁离子,铝离子全部沉淀生成氢氧化铁和氢氧化铝沉淀,得到废渣2的主要成分是Al(OH)3、Fe(OH)3,
故答案为:Al(OH)3、Fe(OH)3;
(2)Mg能与饱和NH4Cl溶液反应产生NH3,氯化铵水解生成盐酸和一水合氨,NH4++H2O?NH3•H2O+H+,镁和氢离子反应生成氢气,氢离子浓度减小,促进平衡正向进行,生成的一水合氨布恩分解生成氨气,Mg+2NH4+=Mg2++2NH3↑+H2↑,
故答案为:氯化铵水解生成盐酸和一水合氨,NH4++H2O?NH3•H2O+H+,镁和氢离子反应生成氢气,氢离子浓度减小,促进平衡正向进行,生成的一水合氨布恩分解生成氨气,Mg+2NH4+=Mg2++2NH3↑+H2↑;
(3)25℃时,1mol•L-1的NaF溶液中c(F-)=1mol/L,结合电离平衡常数Ka=7.2×10-4,c(H+)=$\frac{7.2×1{0}^{-4}}{1}$=7.2×10-4,c(OH-)=$\frac{Kw}{c({H}^{+})}$=$\frac{1{0}^{-14}}{7.2×1{0}^{-4}}$mol/L,一水合氨电离平衡常数数Kb=1.8×10-5.HF的电离常数Ka=7.2×10-4,HF电离程度大,则NH4F溶液中铵根离子水解程度大,溶液显酸性,
故答案为:$\frac{1{0}^{-14}}{7.2×1{0}^{-4}}$;酸性;
(4)已知沉淀前溶液中c(Mg2+)=1.85×10-3mol•L-1,当除镁率达到99%时,c(Mg2+)=1.85×10-5mol•L-1,Ksp (MgF2)=c(Mg2+)c2(F-)=7.4×10-11,c(F-)=$\frac{7.4×1{0}^{-11}}{1.85×1{0}^{-5}}$mol/L,c(F-)=$\sqrt{\frac{7.4×1{0}^{-11}}{1.85×1{0}^{-5}}}$=2.0×10-3mol/L,
故答案为:2.0×10-3;
(5)在NaOH溶液中用NaClO与NiSO4反应可得NiO(OH),同时生成硫酸钠和氯化钠,反应的化学方程式为:2NiSO4+NaClO+4NaOH=2Na2SO4+NaCl+2NiO(OH)+H2O,NiO(OH)与贮氢的镧镍合金可组成镍氢碱性电池(KOH溶液),工作原理为:LaNi5H6+6NiO(OH)$?_{充电}^{放电}$LaNi5+6NiO+6H2O,负极是LaNi5H6失电子生成LaNi5,电极反应为:LaNi5H6+6OH--6e-=LaNi5+6H2O,
故答案为:2NiSO4+NaClO+4NaOH=2Na2SO4+NaCl+2NiO(OH)+H2O;LaNi5H6+6OH--6e-=LaNi5+6H2O.
点评 本题考查了物质分离提纯过程分析、物质性质的应用、电离平衡常数和溶度积常数的计算、原电池电极反应的书写等,掌握基础是解题关键,题目难度中等.

 常温下,将11.65g BaSO4粉末置于盛有250mL蒸馏水的烧杯中,然后向烧杯中加入Na2CO3固体(忽视溶液体积的变化)并充分搅拌,加入Na2CO3固体的过程中,溶液中几种离子的浓度变化曲线如图所示,下列说法中正确的是
常温下,将11.65g BaSO4粉末置于盛有250mL蒸馏水的烧杯中,然后向烧杯中加入Na2CO3固体(忽视溶液体积的变化)并充分搅拌,加入Na2CO3固体的过程中,溶液中几种离子的浓度变化曲线如图所示,下列说法中正确的是( )
| A. | 相同温度时,Ksp(BaSO4)>Ksp(BaCO3) | |
| B. | BaSO4在水中的溶解度、Ksp均比在BaCl2溶液中的大 | |
| C. | 若使0.05molBaSO4全部转化为BaCO3,至少要加入1.25molNa2CO3 | |
| D. | 0.05molBaSO4恰好全部转化为BaCO3时,溶液中离子浓度大小为:c(CO32-)>c(SO42-)>c(OH-)>c(Ba2+) |
| A. | 在密闭容器中充入4molNH3与足量氧气充分反应,达到平衡时放出热量为3623KJ | |
| B. | 平衡时v正(O2)=$\frac{4}{5}$ v逆(NO) | |
| C. | 平衡后降低压强,混合气体平均摩尔质量减小 | |
| D. | 平衡后升高温度,混合气体中NO含量增大 |

| A. | 反应①②中都存在:△S>0 | B. | 反应②高温时,可自发进行 | ||
| C. | 在通常情况下,①②都能自发进行 | D. | 反应①一定不能自发进行 |
| A. | 可用浓硝酸鉴别含苯环的蛋白质 | |
| B. | 淀粉水解与纤维素水解得到的最终产物相同 | |
| C. | 蛋白质、纤维素、蔗糖、油脂都是高分子化合物 | |
| D. | 工业上利用油脂在碱的催化作用下水解生产肥皂 |
| A. | 金刚石和石墨互称同位素 | B. | 甲烷和异丁烷互称同系物 | ||
| C. | 医用消毒酒精中乙醇的浓度为95% | D. | 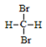 和 和  互称同分异构体 互称同分异构体 |
| A. | 硫原子的原子结构示意图: | |
| B. | 原子核内有10个中子的氧原子:${\;}_{8}^{18}$O | |
| C. | NH4Cl的电子式: | |
| D. | 用电子式表示氯化氢分子的形成过程: |
 能源问题是人类社会面临的重大课题.甲醇是未来重要的绿色能源之一.
能源问题是人类社会面临的重大课题.甲醇是未来重要的绿色能源之一. 元素镍(Ni)在溶液中+3价极不稳定,主要以Ni2+(绿色)、[Ni(NH3)6]2+(蓝色)、[Ni(CN)4]2-(橙黄色)、[Ni(CN)5]3-(深红色)等形式存在.Ni(OH)2为难溶于水的浅绿色固体.
元素镍(Ni)在溶液中+3价极不稳定,主要以Ni2+(绿色)、[Ni(NH3)6]2+(蓝色)、[Ni(CN)4]2-(橙黄色)、[Ni(CN)5]3-(深红色)等形式存在.Ni(OH)2为难溶于水的浅绿色固体.