题目内容
汽车内燃机工作时产生的高温会引起N2和O2 发生反应生成NO气体,其方程式为: N2 (g) +O2(g) 2NO (g),该反应是导致汽车尾气中含有NO的原因之一。
2NO (g),该反应是导致汽车尾气中含有NO的原因之一。

(1)右图表示在T1、T2两种不同温度下,一定量的NO发生反应:2NO(g) N2(g)+O2(g)。反应过程中N2的体积分数随时间变化的图像。升高温度,则反应N2 (g)+O2(g)
N2(g)+O2(g)。反应过程中N2的体积分数随时间变化的图像。升高温度,则反应N2 (g)+O2(g) 2NO (g)的平衡常数K将 (填“增大”、“减小”或“不变”)。
2NO (g)的平衡常数K将 (填“增大”、“减小”或“不变”)。
(2)2000℃时,向容积为2 L的密闭容器中充入10 mol N2与5 mol O2,达到平衡后NO的物质的量为2 mol,则2000℃时反应N2 (g)+O2(g) 2NO (g)的平衡常数K的数值为 。该温度下,若开始时向上述容器中充入N2与O2均为1 mol,则达到平衡后N2的转化率为 。
2NO (g)的平衡常数K的数值为 。该温度下,若开始时向上述容器中充入N2与O2均为1 mol,则达到平衡后N2的转化率为 。
(3)研究发现,用CH4催化还原NOx可以消除氮氧化物的污染。例如:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H1=-574 kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H2=―1160 kJ·mol-1
若1 mol CH4还原NO2至N2,整个过程中放出的热量为 kJ。
 2NO (g),该反应是导致汽车尾气中含有NO的原因之一。
2NO (g),该反应是导致汽车尾气中含有NO的原因之一。
(1)右图表示在T1、T2两种不同温度下,一定量的NO发生反应:2NO(g)
 N2(g)+O2(g)。反应过程中N2的体积分数随时间变化的图像。升高温度,则反应N2 (g)+O2(g)
N2(g)+O2(g)。反应过程中N2的体积分数随时间变化的图像。升高温度,则反应N2 (g)+O2(g) 2NO (g)的平衡常数K将 (填“增大”、“减小”或“不变”)。
2NO (g)的平衡常数K将 (填“增大”、“减小”或“不变”)。(2)2000℃时,向容积为2 L的密闭容器中充入10 mol N2与5 mol O2,达到平衡后NO的物质的量为2 mol,则2000℃时反应N2 (g)+O2(g)
 2NO (g)的平衡常数K的数值为 。该温度下,若开始时向上述容器中充入N2与O2均为1 mol,则达到平衡后N2的转化率为 。
2NO (g)的平衡常数K的数值为 。该温度下,若开始时向上述容器中充入N2与O2均为1 mol,则达到平衡后N2的转化率为 。(3)研究发现,用CH4催化还原NOx可以消除氮氧化物的污染。例如:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H1=-574 kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H2=―1160 kJ·mol-1
若1 mol CH4还原NO2至N2,整个过程中放出的热量为 kJ。
(1)增大
(2)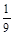 (或0.11)
(或0.11) 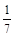 (或14.3%)
(或14.3%)
(3)867
(2)
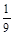 (或0.11)
(或0.11) 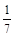 (或14.3%)
(或14.3%) (3)867
试题分析:(1)由图可以知道,2NO(g)
 N2(g)+O2(g)为放热反应,所以N2 (g)+O2(g)
N2(g)+O2(g)为放热反应,所以N2 (g)+O2(g) 2NO (g)为吸热反应,温度高,K增大;
2NO (g)为吸热反应,温度高,K增大;(2) N2 (g)+O2(g)
 2NO (g)
2NO (g)起始浓度mol/L 5 2.5 0
转化浓度mol/L 0.5 0.5 1
平衡浓度mol/L 4.5 2 1
所以,K=1×1÷(4.5×2)=
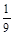 ,设N2达到平衡的物质的量浓度为amol/L,根据平衡常数在同一温度下不变可以得到,
,设N2达到平衡的物质的量浓度为amol/L,根据平衡常数在同一温度下不变可以得到,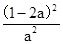 =
=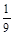 ,解得a=
,解得a=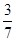 ,所以N2达到平衡的物质的量为
,所以N2达到平衡的物质的量为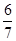 mol,反应的的物质的量为
mol,反应的的物质的量为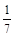 mol,所以达到平衡后N2的转化率为
mol,所以达到平衡后N2的转化率为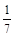 。
。(3)将CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)与CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)相加,可以得到2CH4(g)+4NO2(g) =2CO2(g)+4H2O(g) +2N2(g),△H=-1734 kJ·mol-1,所以1 mol CH4还原NO2至N2,整个过程中放出的热量为867KJ。
点评:该大题综合考查了化学平衡,热化学方程式,是高考的热门考点,该题的难度适中。

练习册系列答案
 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案 一线名师权威作业本系列答案
一线名师权威作业本系列答案
相关题目
 2Fe(s)+3CO2(g) △H
2Fe(s)+3CO2(g) △H

 CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表: 2CO2+N2。为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如表:
2CO2+N2。为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如表: C(s) =
C(s) =  2HCl(g);△H=-184.6kJ·mol-1,
2HCl(g);△H=-184.6kJ·mol-1,



