题目内容
在硫酸的制备中,最后的产品是98%的硫酸或20%的发烟硫酸(H2SO4和SO3的混合物,其中SO3的质量分数为20%)。
(1)若98%硫酸可表示为SO3·aH2O,20%的发烟硫酸可表示为SO3·bH2O,则a、b的值(a、b可用分数表示)分别是:a= ,b= 。
(2)用m(H2O)=k·n(SO3)分别表示SO3转化成上述两种硫酸时,所用水的质量与SO3的物质的量的关系式(即求k)分别是:
m1(H2O)= n1(SO3),m2(H2O)= n2(SO3)。
(3)若工厂同时生产上述两种硫酸,则上述两种硫酸的质量比x(W1为98%的硫酸的质量、W2为20%的发烟硫酸的质量)与SO3的用量的物质的量之比y的关系是 。
(1)若98%硫酸可表示为SO3·aH2O,20%的发烟硫酸可表示为SO3·bH2O,则a、b的值(a、b可用分数表示)分别是:a= ,b= 。
(2)用m(H2O)=k·n(SO3)分别表示SO3转化成上述两种硫酸时,所用水的质量与SO3的物质的量的关系式(即求k)分别是:
m1(H2O)= n1(SO3),m2(H2O)= n2(SO3)。
(3)若工厂同时生产上述两种硫酸,则上述两种硫酸的质量比x(W1为98%的硫酸的质量、W2为20%的发烟硫酸的质量)与SO3的用量的物质的量之比y的关系是 。
(1) 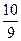
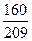
(2)20g·mol-1? 13.8g·mol-1
(3)y=0.938x
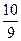
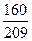
(2)20g·mol-1? 13.8g·mol-1
(3)y=0.938x
(1)“98%的硫酸”指100g硫酸溶液中有98gH2SO4、2gH2O。若用SO3·aH2O表示,则题意为1molSO3、amolH2O,因此,a=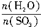 。
。
而对20%的发烟硫酸,100g中应有H2SO4 80g、SO3 20g。
(2)利用(1)中的结果可方便地求解k的值。
(3)分别求出两种浓度时,n(SO3)与W的关系,其比值中非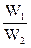 的部分即为所求。
的部分即为所求。
解:(1)对98%的硫酸,有:
?a=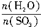 =
=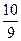
而对20%的发烟硫酸,则有:
?b=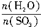 =
=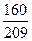
(2)由a=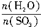 可得:
可得:
?n1(H2O)=a·n1(SO3)
18g·mol-1×n1(H2O)=18g·mol-1×a×n1(SO3)=m1(H2O)
所以k=18g·mol-1×a=20g·mol-1
由b·n2(SO3)=n2(H2O)
18g·mol-1×n2(H2O)=18g·mol-1×b×n2(SO3)
m2(H2O)=18g·mol-1×b×n2(SO3)=18g·mol-1×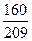 ×n2(SO3)
×n2(SO3)
所以k=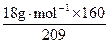 =13.8g·mol-1。
=13.8g·mol-1。
(3)设98%的硫酸所需SO3的用量为n1(SO3),20%的发烟硫酸所需SO3的用量为n2(SO3),则
?n1(SO3)=W1× =
=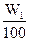
?n2(SO3)=W2×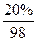 +W2×
+W2×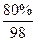 =
=
两式相除得:
y=n1(SO3)∶n2(SO3)=0.938×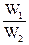 =0.938x。
=0.938x。
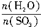 。
。而对20%的发烟硫酸,100g中应有H2SO4 80g、SO3 20g。
(2)利用(1)中的结果可方便地求解k的值。
(3)分别求出两种浓度时,n(SO3)与W的关系,其比值中非
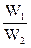 的部分即为所求。
的部分即为所求。解:(1)对98%的硫酸,有:
?a=
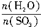 =
=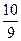
而对20%的发烟硫酸,则有:
?b=
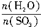 =
=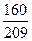
(2)由a=
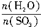 可得:
可得:?n1(H2O)=a·n1(SO3)
18g·mol-1×n1(H2O)=18g·mol-1×a×n1(SO3)=m1(H2O)
所以k=18g·mol-1×a=20g·mol-1
由b·n2(SO3)=n2(H2O)
18g·mol-1×n2(H2O)=18g·mol-1×b×n2(SO3)
m2(H2O)=18g·mol-1×b×n2(SO3)=18g·mol-1×
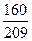 ×n2(SO3)
×n2(SO3)所以k=
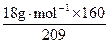 =13.8g·mol-1。
=13.8g·mol-1。(3)设98%的硫酸所需SO3的用量为n1(SO3),20%的发烟硫酸所需SO3的用量为n2(SO3),则
?n1(SO3)=W1×
 =
=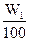
?n2(SO3)=W2×
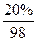 +W2×
+W2×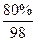 =
=
两式相除得:
y=n1(SO3)∶n2(SO3)=0.938×
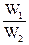 =0.938x。
=0.938x。
练习册系列答案
相关题目