题目内容
【题目】用NA表示阿伏加德罗常数的值。下列说法正确的是
A.常温下,56g铁片投入足量浓H2SO4中,充分反应,生成NA个SO2分子
B.向100mL 1mol·L-1Fe(NO3)3溶液中滴加足量HI溶液,转移0.1NA个电子
C.4.6 g SO2和CO2的混合气体含有的电子数为2.3NA
D.120g NaHSO4固体中阳离子和阴离子的总数为3NA
【答案】C
【解析】
A.常温下,铁片投入足量浓H2SO4中发生钝化,铁表面生成致密的氧化膜,阻止反应继续进行,无法计算,故A错误;
B.向100mL 1mol·L-1Fe(NO3)3溶液中滴加足量HI溶液,酸性条件下,硝酸根离子具有强氧化性,碘离子具有还原性,故铁离子与硝酸根离子都可被碘离子还原,发生氧化还原反应,Fe3++3NO3+12H++10I═Fe2++5I2+3NO↑+6H2O,氧化剂是铁离子和硝酸根离子,铁离子化合价从+3价降低到+2价,硝酸根的氮原子从+5价降低到+2价,有三个氮原子化合价降低,共降低了1+3×3=10,故当0.1mol硝酸铁完全反应后,转移1mol电子即NA个,故B错误;
C.4.6g SO2和CO2的摩尔质量之比等于电子数之比,均为16: 11,故两者的一定质量的混合物中,无论两者的比例如何,虽然混合物的物质的量不是定值,但含有的电子数为定值,即可设混合物全部是CO2,则4.6g CO2的物质的量为n=![]() =0.1045mol,故含有的电子的物质的量n=0.1045mol×22=2.3mol,即为2.3NA个,故C正确;
=0.1045mol,故含有的电子的物质的量n=0.1045mol×22=2.3mol,即为2.3NA个,故C正确;
D.120gNaHSO4的物质的量n=![]() =1mol,而1molNaHSO4固体中含1mol钠离子和1molHSO4,故含2mol离子即2NA个,故D错误;
=1mol,而1molNaHSO4固体中含1mol钠离子和1molHSO4,故含2mol离子即2NA个,故D错误;
答案选C。

【题目】有机物 W 在医药和新材料等领域有广泛应用。W 的一种合成路线如图:
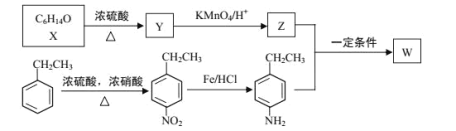
已知部分信息如下:
① | 1molY完全反应生成2molZ,且在加热条件下Z不能和新制氢氧化铜悬浊液反应 |
② |
|
③ | RCH2NH2+ |
请回答下列问题:
(1)Y 的化学名称是___;Z 中官能团的名称是___;
(2)![]() 中_____________(填“有”或“无”)手性碳原子;图示中 X 转化为 Y 的反应类型是___。
中_____________(填“有”或“无”)手性碳原子;图示中 X 转化为 Y 的反应类型是___。
(3)生成 W 的化学方程式为___。
(4)G 是对硝基乙苯的同分异构体,G 能和碳酸钠反应产生气体且分子中含有—NH2(氨基),G的同分异构体有___种(不考虑立体结构),其中在核磁共振氢谱上峰的面积比为 1∶2∶2∶2∶2 的结构简式为_________________。
(5)设计以苯乙烯和丙酮为原料制备药物中间体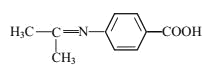 的合成路线__________(无机试剂自选)。
的合成路线__________(无机试剂自选)。
【题目】X、Y、Z、W是中学化学常见的四种物质,他们之间具有如图所示转化关系,则下列组合不可能的是

X | Y | Z | W | |
A | C | CO | CO2 | O2 |
B | Na | Na2O | Na2O2 | O2 |
C | AlCl3 | Al(OH)3 | NaAl(OH)4 | NaOH |
D | Fe | FeCl2 | FeCl3 | Cl2 |
A. AB. BC. CD. D