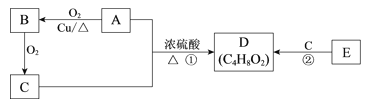
题目内容
【题目】下列各项操作中,会产生“先沉淀后溶解”现象的是
A.向![]() 溶液中通入过量
溶液中通入过量![]() B.向
B.向![]() 溶液中加入足量金属钠
溶液中加入足量金属钠
C.向![]() 溶液中滴入过量盐酸D.向沸水中滴加饱和
溶液中滴入过量盐酸D.向沸水中滴加饱和![]() 溶液
溶液
【答案】B
【解析】
A.因为HCl的酸性比H2CO3的酸性强,所以氯化钙溶液中通入过量的二氧化碳没有明显现象,故A不符合题意;
B.钠和水反应生成NaOH,NaOH和氯化铝反应生成氢氧化铝沉淀,当钠过量,即NaOH过量时,氢氧化铝和氢氧化钠反应生成偏铝酸钠,沉淀溶解,故B符合题意;
C.硅酸不溶于酸和水,所以向硅酸钠溶液中滴入过量盐酸,只有沉淀生成,而不会出现沉淀的溶解,故C不符合题意;
D.沸水中滴加氯化铁饱和溶液先生成氢氧化铁胶体,继续滴加氯化铁溶液发生胶体的聚沉,产生沉淀,再继续滴加,沉淀不会溶解,故D不符合题意;
故答案为B。

 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案【题目】二氧化钛是目前使用最广泛的白色颜料。工业上,以钛铁矿(主要成分为钛酸亚铁[FeTiO3],含有少量SiO2杂质)为原料制备二氧化钛的过程如下图所示。
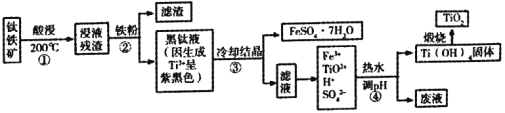
已知:①超过70℃TiO2+易水解;低于0℃ FeSO4·7H2O大量结晶。
②钛的化合价主要有+4价和+3价,其中Ti3+(紫黑色)还原性比Fe2+强
③有关氢氧化物开始沉淀的pH如下:
氢氧化物 | Ti(OH)4 | Ti(OH)3 | Fe(OH)3 | Fe(OH)2 |
开始沉淀时的pH | 0.5 | 3.0 | 1.5 | 7.6 |
根据相关信息回答下列问题;
(1)酸浸过程选用的酸是__________。
(2)步骤①中生成Fe2+和TiO2+的化学反应方程式为__________。
(3)以下相关描述正确的是__________。
A 步骤②中加入铁粉,在防止Fe2+转化成Fe3+的同时也将部分TiO2+氧化成了Ti3+
B 步骤③中的降温结晶过程可以选择冰水混合物
C ③中发生了反应Fe3++ Ti3++H2O== Fe2++ TiO2++2H+
D 废液成分中有硫酸,可以循环利用
(4)步④中生成Ti(OH)4的离子方程式为__________,选择的pH范围是__________。
(5)证明步骤④中Ti (OH)4固体已经洗涤干净的方法是__________。
(6)钛酸锂(Li4Ti5O12)是一种理想型嵌入材料,插入与脱嵌对材料结构几乎没影响。某新型钛酸锂电池总反应式为:LiXO2(s)+Li4Ti5O12(s)=Li1-aXO2+Li4+aTi5O12(s),则其负极反应式为__________。