��Ŀ����
����Ŀ�������ҹ�����ϲ������Ʒ��ijУ��ѧ��ȤС���ͬѧ�������ʵ�������Լ����Ҷ�к���Ca��Al��Fe����Ԫ�ء�
�����IJ������ϡ������[(NH4)2C2O4]����������ʡ������(CaC2O4)������ˮ��Ca2����Al3����Fe3����ȫ������pH��Ca(OH)2��pH��13��Al(OH)3��pH��5.5��Fe(OH)3��pH��4.1��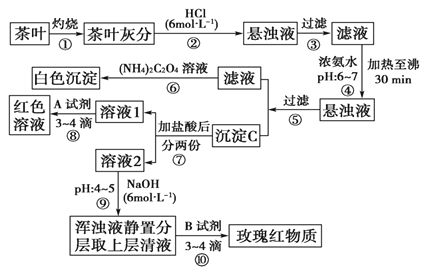
�Ը����������̼���Ϣ��գ�
��1������ڼ��������������
��2��д������Ca2�������ӷ���ʽ����
��3��д������C������Ҫ���ʵĻ�ѧʽ����
��4��д���������A�Լ����ɺ�ɫ��Һ�����ӷ���ʽ��
��5�������������� ��
�²ⲽ����Ŀ������
���𰸡�
��1��ʹCa2����Al3����Fe3������(��ʹCa2����Al3����Fe3���ܽ�)
��2��Ca2����(NH4)2C2O4=CaC2O4����2NH4+
��3��Fe(OH)3��Al(OH)3
��4��
Fe3����3SCN�� = Fe(SCN)3(д��������ȷ�����������ʽҲ��)
��5��ʹFe3��ת��ΪFe(OH)3����������Al3��(����Ԫ��)����
���������û�ѧ�������롢����ֲ����Ʒ�е�ijЩԪ��ʱ��ͨ�����������ֲ����Ʒ�������գ�ʹ���е��л���ֽ⡣���е�̼���⡢����Ԫ��ת��Ϊ������̼��ˮ������̬��ɢ������Ľ�����ǽ���Ԫ���������������(�ƻҷ�)����ʽ�����������ڲ����Ļҷ��м���ˮ���ᣬʹ�ҷ��ܽ⡣���˺���Һ�����ڷ���ͼ���ijЩԪ�ء�