题目内容
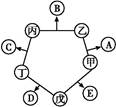
甲、乙、丙、丁、戊五种单质在一定条件下反应生成A、B、C、D、E五种化合物,其转化关系如图所示。又知:①甲、乙、丙、丁均为前三周期元素的单质,常温下均为气态,丙、丁是空气的主要成分,戊是应用最广泛的金属。②乙在甲中燃烧发出苍白色火焰,E的水溶液呈黄色。回答下列问题:
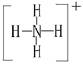
(1)A与B可反应,产物中阳离子的结构式为 。
(2)A与B的沸点比较,较高的是 (写化学式)。
(3)E的水溶液可使KI淀粉溶液变蓝,写出该反应的离子方程式: 。
(4)工业上可由B与丁反应制取C,写出该反应的化学方程式: 。
(5)将甲和E同时加(通)入强碱性溶液中,可制得一种高效杀菌、净水剂(其中含由+6价戊元素形成的带2个单位负电荷的含氧酸根离子),请写出该反应的离子方程式: 。
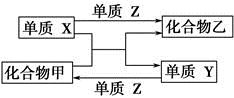
(6)用以上金属戊作电极,利用如图装置,可以模拟金属的电化学防护。若X为碳棒,为减缓戊的腐蚀,开关K应置于 处。若X为锌,开关K置于M处,该电化学防护法称为 。

(1)A与B可反应,产物中阳离子的结构式为 。
(2)A与B的沸点比较,较高的是 (写化学式)。
(3)E的水溶液可使KI淀粉溶液变蓝,写出该反应的离子方程式: 。
(4)工业上可由B与丁反应制取C,写出该反应的化学方程式: 。
(5)将甲和E同时加(通)入强碱性溶液中,可制得一种高效杀菌、净水剂(其中含由+6价戊元素形成的带2个单位负电荷的含氧酸根离子),请写出该反应的离子方程式: 。
(6)用以上金属戊作电极,利用如图装置,可以模拟金属的电化学防护。若X为碳棒,为减缓戊的腐蚀,开关K应置于 处。若X为锌,开关K置于M处,该电化学防护法称为 。
(1) (2)NH3
(2)NH3
(3)2Fe3++2I- 2Fe2++I2
2Fe2++I2
(4)4NH3+5O2 4NO+6H2O
4NO+6H2O
(5)2Fe3++3Cl2+16OH- 2Fe
2Fe +6Cl-+8H2O[或2Fe(OH3+3Cl2+10OH-
+6Cl-+8H2O[或2Fe(OH3+3Cl2+10OH- 2Fe
2Fe +6Cl-+8H2O]
+6Cl-+8H2O]
(6)N 牺牲阳极的阴极保护法
 (2)NH3
(2)NH3(3)2Fe3++2I-
 2Fe2++I2
2Fe2++I2(4)4NH3+5O2
 4NO+6H2O
4NO+6H2O(5)2Fe3++3Cl2+16OH-
 2Fe
2Fe +6Cl-+8H2O[或2Fe(OH3+3Cl2+10OH-
+6Cl-+8H2O[或2Fe(OH3+3Cl2+10OH- 2Fe
2Fe +6Cl-+8H2O]
+6Cl-+8H2O](6)N 牺牲阳极的阴极保护法
根据图示和②乙在甲中燃烧发出苍白色火焰,则甲为Cl2,乙为H2,A为HCl。又因E的水溶液呈黄色,则E中应含Fe3+,即戊为Fe,E为FeCl3。又因丙、丁是空气的主要成分,即为N2和O2中的一种,再根据转化关系图,丁与戊(Fe)反应,故丁为O2,则丙为N2,B为NH3,C为NO,D为Fe2O3或Fe3O4。(1)A(HCl)与B(NH3)反应生成NH4Cl,N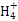 的结构式为
的结构式为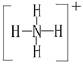 。(2)由于NH3分子间存在氢键,故NH3的沸点比HCl的高。(3)Fe3+具有氧化性,I-具有还原性,两者混合可发生反应:2Fe3++2I-
。(2)由于NH3分子间存在氢键,故NH3的沸点比HCl的高。(3)Fe3+具有氧化性,I-具有还原性,两者混合可发生反应:2Fe3++2I- 2Fe2++I2。(4)工业上制取NO是将NH3催化氧化得到,其反应为:4NH3+5O2
2Fe2++I2。(4)工业上制取NO是将NH3催化氧化得到,其反应为:4NH3+5O2 4NO+6H2O。(5)由题中信息可知反应物有Cl2、Fe3+和OH-,生成物有Fe
4NO+6H2O。(5)由题中信息可知反应物有Cl2、Fe3+和OH-,生成物有Fe ,根据氧化还原反应的规律和原子守恒可推知生成物中还有Cl-和H2O,故反应的离子方程式为:2Fe3++3Cl2+16OH-
,根据氧化还原反应的规律和原子守恒可推知生成物中还有Cl-和H2O,故反应的离子方程式为:2Fe3++3Cl2+16OH- 2Fe
2Fe +6Cl-+8H2O或2Fe(OH)3+3Cl2+10OH-
+6Cl-+8H2O或2Fe(OH)3+3Cl2+10OH- 2Fe
2Fe +6Cl-+8H2O。(6)若X为碳棒,为减缓铁的腐蚀,则K应置于N处;若X为Zn,K置于M处,构成原电池,此法称为牺牲阳极的阴极保护法。
+6Cl-+8H2O。(6)若X为碳棒,为减缓铁的腐蚀,则K应置于N处;若X为Zn,K置于M处,构成原电池,此法称为牺牲阳极的阴极保护法。
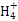 的结构式为
的结构式为 。(2)由于NH3分子间存在氢键,故NH3的沸点比HCl的高。(3)Fe3+具有氧化性,I-具有还原性,两者混合可发生反应:2Fe3++2I-
。(2)由于NH3分子间存在氢键,故NH3的沸点比HCl的高。(3)Fe3+具有氧化性,I-具有还原性,两者混合可发生反应:2Fe3++2I- 2Fe2++I2。(4)工业上制取NO是将NH3催化氧化得到,其反应为:4NH3+5O2
2Fe2++I2。(4)工业上制取NO是将NH3催化氧化得到,其反应为:4NH3+5O2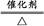 4NO+6H2O。(5)由题中信息可知反应物有Cl2、Fe3+和OH-,生成物有Fe
4NO+6H2O。(5)由题中信息可知反应物有Cl2、Fe3+和OH-,生成物有Fe ,根据氧化还原反应的规律和原子守恒可推知生成物中还有Cl-和H2O,故反应的离子方程式为:2Fe3++3Cl2+16OH-
,根据氧化还原反应的规律和原子守恒可推知生成物中还有Cl-和H2O,故反应的离子方程式为:2Fe3++3Cl2+16OH- 2Fe
2Fe +6Cl-+8H2O或2Fe(OH)3+3Cl2+10OH-
+6Cl-+8H2O或2Fe(OH)3+3Cl2+10OH- 2Fe
2Fe +6Cl-+8H2O。(6)若X为碳棒,为减缓铁的腐蚀,则K应置于N处;若X为Zn,K置于M处,构成原电池,此法称为牺牲阳极的阴极保护法。
+6Cl-+8H2O。(6)若X为碳棒,为减缓铁的腐蚀,则K应置于N处;若X为Zn,K置于M处,构成原电池,此法称为牺牲阳极的阴极保护法。
练习册系列答案
相关题目

 ,下列说法正确的是
,下列说法正确的是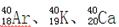 的质量数相同,所以它们互为同位素
的质量数相同,所以它们互为同位素