题目内容
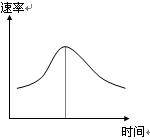
氯酸钾和亚硫酸氢钠发生氧化还原反应生成Cl(-1价)和S(+6价)的速率如图所示,已知这个反应速率随着溶液中c(H+)增大而加快。

(1)反应开始时反应速率加快的原因是_______________________________________。
(2)反应后期反应速率下降的原因是_________________________________________。
(3)若纵坐标表示的某一反应物的单位时间内的浓度变化,图中阴影部分的“面积”表示_________________________ _______________。
【解析】 问题(1)作为已知考虑,开始时反应速率加快,有哪些因素能引起溶液中反应速率加快呢?①增加浓度,②增压,③升温,④加正催化剂。联系题意可排除②④,由于题意中不涉及热量变化,故不需考虑③;接下来考虑①,但题中无外加物,所以只考虑c(H+)的变化,KClO3![]() Cl-,NaHSO3
Cl-,NaHSO3![]() SO
SO![]() +H++Na+,c(H+)增大,反应速率v增大。
+H++Na+,c(H+)增大,反应速率v增大。
【答案】 (1)2KClO3+6NaHSO3=3Na2SO4+2KCl+3H2SO4溶液中c(H+)增大,化学反应速率加快
(2)H2SO4和NaHSO3之间反应使H+及HSO![]() 浓度减小,化学反应速率减慢
浓度减小,化学反应速率减慢
(3)t1~t2段时某一反应物浓度的减小值

练习册系列答案
 金博士一点全通系列答案
金博士一点全通系列答案
相关题目