题目内容
【题目】铬及其化合物具有广泛应用。请回答下列问题:
(1)![]() 与
与![]() 的化学性质相似。向
的化学性质相似。向![]() 溶液中加入过量NaOH溶液,反应的离子方程式为______;加热
溶液中加入过量NaOH溶液,反应的离子方程式为______;加热![]() 溶液,灼烧固体,所得固体的成分是______。
溶液,灼烧固体,所得固体的成分是______。
(2)![]() 和
和![]() 在溶液中可相互转化
在溶液中可相互转化![]() 室温下,初始浓度为
室温下,初始浓度为![]() 的
的![]() 溶液中
溶液中![]() 随
随![]() 的变化如图所示。
的变化如图所示。

①下列可判断反应达平衡状态的是______![]() 填标号
填标号![]() 。
。
A.溶液的pH不再变化
B.![]()
C.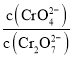 为定值
为定值
②A点![]() 点的逆反应速率大小为
点的逆反应速率大小为![]() 逆
逆![]() ______
______![]() 逆
逆![]() 填:“
填:“![]() ”、“=”或“
”、“=”或“![]() ”
”![]() 。
。
③由图得出,溶液酸性增强,![]() 的平衡转化率______
的平衡转化率______![]() 填“增大”、“减小”或“不变”
填“增大”、“减小”或“不变”![]() ;
;![]() 时,该反应的平衡常数为______。
时,该反应的平衡常数为______。
(3)化学分析中采用![]() 为指示剂,以
为指示剂,以![]() 标准溶液滴定溶液中的
标准溶液滴定溶液中的![]() ,利用
,利用![]() 与
与![]() 生成砖红色沉淀,指示到达滴定终点。硝酸银标准液应盛放在______
生成砖红色沉淀,指示到达滴定终点。硝酸银标准液应盛放在______![]() 填:“酸式”、“碱式”
填:“酸式”、“碱式”![]() 滴定管中。
滴定管中。
(4)常温下,铬酸![]() ,
,![]() ,
,![]() 溶液中离子浓度由大到小的顺序为______。
溶液中离子浓度由大到小的顺序为______。
【答案】![]()
![]()
![]() < 增大
< 增大 ![]() 酸式
酸式 ![]()
【解析】
(1)Cr3+与Al3+的化学性质相似可知Cr2(SO4)3溶液中逐滴加入NaOH溶液,先生成Cr(OH)3灰蓝色沉淀,继续加入NaOH后沉淀溶解,生成绿色的Cr(OH)4,反应的离子方程式为:Cr3++4OH=[Cr(OH)4],加热CrCl3溶液,促进水解生成氢氧化铬,灼烧固体氢氧化铬生成Cr2O3;
(2)①CrO42和Cr2O72在溶液中可相互转化2CrO42+2H+![]() Cr2O72+H2O,平衡标志是正逆反应速率相同,各组分含量保持不变,
Cr2O72+H2O,平衡标志是正逆反应速率相同,各组分含量保持不变,
A.溶液的pH不再变化说明氢离子浓度不变,反应达到平衡状态,故A正确;
B.速率之比等于化学方程式计量数之比,v(H+)=2v(Cr2O72)不能说明正逆反应速率相同,不能说明反应达到平衡状态,故B错误;
C. 为定值说明其物质的量不变,反应达到平衡状态,故C正确;
为定值说明其物质的量不变,反应达到平衡状态,故C正确;
答案选AC。
②A点B点氢离子浓度增大平衡正向进行,逆反应速率增大,反应的逆反应速率大小为vA(逆)<vB(逆)。
③由图得出,溶液酸性增强,K2CrO4的平衡转化率增大,结合A点计算平衡常数。A点Cr2O72的浓度为0.25mol/L,则消耗的CrO42的浓度为0.5mol/L,则溶液中的c(CrO42)=1.0mol/L-0.25mol/L×2=0.5mol/L,c(H+)=1×107mol/L,此时该转化反应的平衡常数为K= =1.0×1014;
=1.0×1014;
(3)硝酸银溶液为强酸弱碱盐,银离子水解溶液显酸性,硝酸银标准液应盛放在酸式滴定管中;
(4)常温下,铬酸(H2CrO4)Ka1=4.1,Ka2=105.9,KHCrO4溶液中铬酸氢根的水解常数Kh= =
=![]() =2.4×1014<Ka2,所以铬酸氢根的电离程度大于水解程度,溶液显酸性,所以离子浓度由大到小的顺序为
=2.4×1014<Ka2,所以铬酸氢根的电离程度大于水解程度,溶液显酸性,所以离子浓度由大到小的顺序为![]() 。
。

 浙大优学小学年级衔接捷径浙江大学出版社系列答案
浙大优学小学年级衔接捷径浙江大学出版社系列答案



