题目内容
下列解释实验事实的平衡不正确的是
| | 实 验 | 解释 |
| A | 100℃ 0.1 mol/LNa2SO4溶液pH= 6.2 | H2O H+ + OH- H+ + OH- |
| B | 0.1 mol/L CH3COOH的pH=3 | CH3COOH CH3COO- + H+ CH3COO- + H+ |
| C | 配制FeCl3溶液时加少量盐酸 | Fe3+ + 3OH- Fe(OH)3 Fe(OH)3 |
| D | 用稀硫酸洗涤BaSO4,沉淀损失小 | BaSO4(s)  Ba2+(aq) + SO42-(aq) Ba2+(aq) + SO42-(aq) |
C
试题分析:A、温度升高,H2O的电离平衡向右移动,正确;B、CH3COOH为弱酸,部分电离,存在电离平衡:CH3COOH
 CH3COO?+H+,正确;C、配制FeCl3溶液时加少量盐酸,目的是抑制Fe3+的水解,Fe3++3H2O
CH3COO?+H+,正确;C、配制FeCl3溶液时加少量盐酸,目的是抑制Fe3+的水解,Fe3++3H2O Fe(OH)3+3H+,错误;D、用稀硫酸洗涤BaSO4,使BaSO4的沉淀溶解平衡:BaSO4(s)
Fe(OH)3+3H+,错误;D、用稀硫酸洗涤BaSO4,使BaSO4的沉淀溶解平衡:BaSO4(s)  Ba2+(aq) + SO42-(aq),向左移动,正确。
Ba2+(aq) + SO42-(aq),向左移动,正确。
练习册系列答案
相关题目
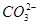 、
、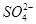 、
、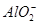 、
、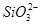 、
、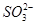
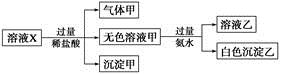
 Ag+(aq)+Cl-(aq)在25℃时,AgCl的Ksp=1.8×10-10。现将足量AgCl分别放入下列液体中:①100 mL蒸馏水 ②100 mL 0.3 mol·L-1 AgNO3溶液 ③100 mL 0.1 mol·L-1MgCl2溶液充分搅拌后冷却到相同温度,Ag+浓度由大到小的顺序为 (填序号),此时溶液②中Cl-物质的量浓度为 。
Ag+(aq)+Cl-(aq)在25℃时,AgCl的Ksp=1.8×10-10。现将足量AgCl分别放入下列液体中:①100 mL蒸馏水 ②100 mL 0.3 mol·L-1 AgNO3溶液 ③100 mL 0.1 mol·L-1MgCl2溶液充分搅拌后冷却到相同温度,Ag+浓度由大到小的顺序为 (填序号),此时溶液②中Cl-物质的量浓度为 。 2Cu↓ +O2↑ +4H+
2Cu↓ +O2↑ +4H+ Fe(OH)3(胶体)+3H+
Fe(OH)3(胶体)+3H+