题目内容
【题目】表是元素周期表的一部分,针对表中的①﹣⑧八种元素,用元素符号或化学式回答相关问题:
族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
二 | ① | |||||||
三 | ② | ③ | ④ | ⑤ | ⑥ | |||
四 | ⑦ | ⑧ |
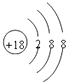
(1)在这些元素中,化学性质最不活泼原子的原子结构示意图为 .
(2)用电子式表示①与③形成化合物的过程 .
(3)这些元素的最高价氧化物对应的水化物中,酸性最强的是 , ②、④的最高价氧化物对应水化物的溶液反应的离子方程式为: .
(4)①②③④四种元素的简单离子半径由大到小的顺序是 . (用离子符号和“>”表示).
(5)①⑤⑧三种元素的单质沸点由高到低的顺序是 . (用化学式和“>”表示).
【答案】
(1)
(2)![]()
(3)HClO4;Al(OH)3+OH﹣=AlO2﹣+2H2O
(4)F﹣>Na+>Mg2+>Al3+
(5)Br2>Cl2>F2
【解析】解:根据元素周期表中短周期元素的分布情况,可以知道①是F,②是Na,③是Mg,④是Al,⑤是Cl,⑥是Ar,⑦是K,⑧是Br.(1)在这些元素中,化学性质最不活泼的元素的原子是稀有气体元素的原子,即为Ar,原子结构示意图为  ,所以答案是:
,所以答案是:  ;(2)氟化镁是氟离子和镁离子间通过离子键形成的离子化合物,其形成过程为
;(2)氟化镁是氟离子和镁离子间通过离子键形成的离子化合物,其形成过程为 ![]() ,所以答案是:
,所以答案是: ![]() ;(3)周期表中从左到右元素最高价氧化物对应水化物的碱的碱性逐渐增减弱,从上到下元素最高价氧化物对应水化物的碱的碱性逐渐增强,所以酸性最强的是HClO4;②、④的最高价氧化物对应水化物分别是NaOH和Al(OH)3 , 两者反应的实质是:Al(OH)3+OH﹣=AlO2﹣+2H2O,所以答案是:HClO4;Al(OH)3+OH﹣=AlO2﹣+2H2O;(4)F﹣、Na+、Mg2+、Al3+的简单离子核外电子数均为10,核外电子数一样的离子则核电荷数越多半径越小,即F﹣>Na+>Mg2+>Al3+ , 所以答案是:F﹣>Na+>Mg2+>Al3+;(5)氟气、氯气、液溴单质的分子量逐渐增大,沸点由高到低的顺序是Br2>Cl2>F2 , 所以答案是:Br2>Cl2>F2 .
;(3)周期表中从左到右元素最高价氧化物对应水化物的碱的碱性逐渐增减弱,从上到下元素最高价氧化物对应水化物的碱的碱性逐渐增强,所以酸性最强的是HClO4;②、④的最高价氧化物对应水化物分别是NaOH和Al(OH)3 , 两者反应的实质是:Al(OH)3+OH﹣=AlO2﹣+2H2O,所以答案是:HClO4;Al(OH)3+OH﹣=AlO2﹣+2H2O;(4)F﹣、Na+、Mg2+、Al3+的简单离子核外电子数均为10,核外电子数一样的离子则核电荷数越多半径越小,即F﹣>Na+>Mg2+>Al3+ , 所以答案是:F﹣>Na+>Mg2+>Al3+;(5)氟气、氯气、液溴单质的分子量逐渐增大,沸点由高到低的顺序是Br2>Cl2>F2 , 所以答案是:Br2>Cl2>F2 .

 阅读快车系列答案
阅读快车系列答案