题目内容
仅用下表提供的玻璃仪器(非玻璃仪器任选)或实验装置(图2、图3)就能实现相应实验目的是
| 选项 | A | B | C | D |
| 实验目的 | 除去KCl中少量MnO2 | 用10mol?L-1盐酸配制100mL 0.1mol?L-1盐酸 | 用NaCl溶液制备氯化钠晶体 | 除去C2H4中少量SO2 |
| 实验仪器 | 烧杯、玻璃棒、分液漏斗 | 100mL容量瓶、玻璃棒、烧杯 | 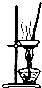 | 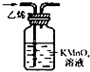 |
C
解析试题分析:A、采用溶解过滤的方法,用到烧杯、玻璃棒、漏斗等仪器,错误;B、还缺少的仪器有量筒、胶头滴管等,错误;C、采用蒸发结晶的方法,正确;D、乙烯和SO2均能被高锰酸钾溶液氧化,错误。
考点:考查化学实验中物质的分离与提纯有关问题。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
某同学为检验溶液中是否含有常见的四种无机离子,进行了下图所示的实验操作。其中检验过程中产生的气体能使湿润的红色石蕊试纸变蓝。由该实验能得到的正确结论是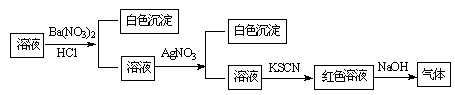
| A.原溶液中一定含有SO42-离子 | B.原溶液中一定含有NH4+离子 |
| C.原溶液中一定含有Cl-离子 | D.原溶液中一定含有Fe3+离子 |
下列实验操作中错误的是 ( )
| A.蒸发操作时,不能等到混合物中的水分完全蒸干后,才停止加热 |
| B.蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处 |
| C.分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 |
| D.萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大 |
已知MgO、MgCl2的熔点分别为2800℃、604℃,将MgO、MgCl2加热熔融后通电电解,都可得到金属镁。海水中含有MgCl2,工业上从海水中提取镁,正确的方法是 ( )
A.海水 Mg(OH)2 Mg(OH)2 Mg Mg |
B.海水 MgCl2溶液 MgCl2溶液 MgCl2熔融 MgCl2熔融 Mg Mg |
C.海水 Mg(OH)2 Mg(OH)2 MgO MgO Mg Mg |
D.海水 Mg(OH)2 Mg(OH)2 MgCl2溶液 MgCl2溶液  MgCl2熔融 MgCl2熔融 Mg Mg |
实验是化学研究的基础,关于下列各实验装置的叙述中,正确的是
| A.装置①常用于分离沸点不同的液体混合物 |
| B.装置②用于吸收氨气,能够防止倒吸 |
| C.以NH4Cl为原料,装置③可制备少量NH3 |
| D.装置④a口进气可收集Cl2、NO等气体 |
不需其他试剂就能区别的一组溶液是
| A.Na2CO3、NaCl、HCl、KNO3 |
| B.KNO3、K2CO3、BaCl2、Na2SO4 |
| C.NaOH、FeCl3、Ba(NO3)2、KCl |
| D.NaCl、BaCl2、CuSO4、NaOH |
下列试验中,所选装置不合理的是 ( )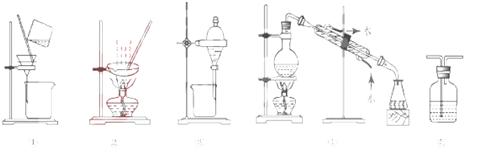
| A.分离Na2CO3溶液和CH3COOC2H5,选④ |
| B.用CC14提取碘水中的碘,选③ |
| C.用FeC12,溶液吸收C12选⑤ |
| D.粗盐提纯,选①和② |
下列根据实验操作和现象所得出的结论正确的是:
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 向溶液中滴加盐酸酸化的BaCl2溶液 | 产生白色沉淀 | 溶液中不一定含有SO42- |
| B | 向溶液X中先滴加稀NaOH溶液,再将湿润红色石蕊试纸置于试管口附近 | 试纸不变蓝 | 原溶液中无NH4+ |
| C | 向PbO2中滴入浓盐酸 | 有黄绿色气体 | PbO2具有氧化性 |
| D | 向溶液X中加入稀盐酸,并将产生的 无色气体通入澄清石灰水中 | 有白色沉淀生成 | 溶液X中一定含有CO32- |
下列实验,所选装置不合理的是
① ② ③ ④
| A.除去CO2中的HCl,选① |
| B.分离碘的CCl4溶液和水,选② |
| C.除去乙醇中的苯酚,选③ |
| D.分离CCl4(沸点76.8℃)和正丁醇(沸点117.2℃),选④ |