题目内容
下列实验操作中错误的是 ( )
| A.蒸发操作时,不能等到混合物中的水分完全蒸干后,才停止加热 |
| B.蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处 |
| C.分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 |
| D.萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大 |
D
解析试题分析:A选项,正确,加热至出现粘稠物时,停止加热,用余温蒸干水份。B、C选项正确。D选项,萃取剂的选择应根据被萃取物和原溶液的性质,萃取剂不一定必须比水大。
考点:实验操作副规范。

练习册系列答案
相关题目
下列除杂所选用的试剂(括号内为杂质)及操作方法均正确的一组是
| 选项 | 待提纯的物质 | 选用的试剂 | 操作方法 |
| A | NaOH(Na2CO3) | 盐酸 | - |
| B | CO2(CO) | 氧气 | 加热 |
| C | Fe(Zn) | FeSO4溶液 | 过滤 |
| D | NaCl(Na2SO4) | BaCl2溶液 | 分液 |
为了除去粗盐中的Ca2+、Mg2+、SO42-及泥沙,可将粗盐溶于水,然后进行下列五项操作:①过滤;②加过量NaOH溶液;③加适量盐酸;④加过量Na2CO3溶液;⑤加过量BaCl2溶液。不正确的操作顺序是
| A.①④②⑤③ | B.⑤④②①③ | C.②⑤④①③ | D.⑤②④①③ |
下列实验操作、现象和解释都正确的是
| 选项 | 实验操作 | 现象 | 解释 |
| A. | 向某溶液中加入盐酸 | 产生无色气体 | 溶液中一定含有CO32? |
| B. | 新制Fe(OH)2露置于空气中一段时间 | 白色固体迅速变为灰绿色,最终变为红褐色 | 说明Fe(OH)2易被氧化成Fe(OH)3 |
| C. | 在CuSO4溶液中加入KI溶液,再加入苯,振荡 | 有白色沉淀生产,苯层呈紫色 | 白色沉淀可能为CuI |
| D. | 向某无色溶液中滴加硝酸酸化的BaCl2溶液 | 产生白色沉淀 | 溶液中一定含有SO42- |
除去NaCl中混有的 MgCl2、Na2SO4时选用试剂依次为( )
| A.NaOH、BaCl2、Na2CO3、HCl |
| B.Ca(OH) 2、Mg(NO3) 2、Na2CO3、HCl |
| C.NaOH、Ba(NO3) 2、Na2CO3、HCl |
| D.Na2CO3、BaCl2、HCl |
下列有关实验的做法错误的是
| A.分液时,分液漏斗中的上层液体应由上口倒出 |
| B.用加热的方法可区分碳酸钠和碳酸氢钠两种固体 |
| C.用渗析的方法可除去Fe(OH)3胶体中混有的Cl- |
| D.加入适量的NaOH可除去NaHCO3溶液中混有的少量Na2CO3 |
仅用下表提供的玻璃仪器(非玻璃仪器任选)或实验装置(图2、图3)就能实现相应实验目的是
| 选项 | A | B | C | D |
| 实验目的 | 除去KCl中少量MnO2 | 用10mol?L-1盐酸配制100mL 0.1mol?L-1盐酸 | 用NaCl溶液制备氯化钠晶体 | 除去C2H4中少量SO2 |
| 实验仪器 | 烧杯、玻璃棒、分液漏斗 | 100mL容量瓶、玻璃棒、烧杯 | 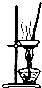 | 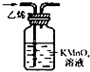 |
如下图所示,利用海水可提取很多重要的化工原料。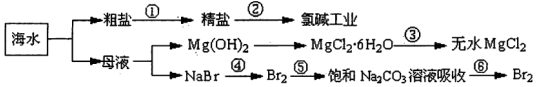
下列有关说法正确的是.( )。
| A.第①步中除去粗盐中的SO42-、Ca2+、Mg2+、Fe3+等杂质,加入的药品顺序为:Na2CO3溶液→NaOH溶液→BaCl2溶液→过滤后加盐酸 |
| B.第②步中工业上可采用石墨为阴极,铁为阳极,采用阳离子交换膜的电解装置 |
| C.第③步中结晶出的MgCl2·6H2O可在空气中受热分解制无水MgCl2 |
| D.在第④步中溴元素被氧化,第⑤、⑥步中既有溴元素被氧化也有溴元素被还原 |
可用来鉴别乙烯、四氯化碳、苯的方法是
| A.磺化反应 | B.溴水 | C.液溴 | D.硝化反应 |