题目内容
 在如图所示的物质转化关系中,A是海水中含量最丰富的盐,B是常见的无色液体,F在D中燃烧发出苍白色火焰.H可用于制造光导纤维,J是一种乳白色凝胶状沉淀.(部分生成物和部分反应条件未列出)
在如图所示的物质转化关系中,A是海水中含量最丰富的盐,B是常见的无色液体,F在D中燃烧发出苍白色火焰.H可用于制造光导纤维,J是一种乳白色凝胶状沉淀.(部分生成物和部分反应条件未列出)
请回答下列问题:
(1)A的电子式为______;形成单质D的元素在周期表中的位置______;
(2)形成C、D、F单质的元素半径由大到小的顺序(填写元素符号)______;
(3)C长期暴露在空气中,最终产物是______
(4)H的化学式为______;H在高温下与碳反应,若转移4mol电子参加反应的碳为______mol.
(5)写出反应①的离子方程式______
(6)写出反应②的化学方程式______.
解:A是海水中含量最丰富的盐,应为NaCl,电解生成Na和Cl2,B是常见的无色液体,应为H2O,则A和B的电解应为电解饱和食盐水,生成Cl2、H2和NaOH,F在D中燃烧发出苍白色火焰,则F为H2,D为Cl2,C为Na,E为NaOH,G为HCl,H可用于制造光导纤维,应为SiO2,则I为Na2SiO3,J是一种乳白色凝胶状沉淀,为H2SiO3,Cl2和NaOH反应生成NaCl和NaClO,K为NaCl和NaClO的混合物,
(1)由以上分析可知A为NaCl,为离子化合物,电子式为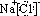 ,D为Cl2,Cl元素在周期表中的位置是第三周期ⅦA族,
,D为Cl2,Cl元素在周期表中的位置是第三周期ⅦA族,
故答案为: ;第三周期ⅦA族;
;第三周期ⅦA族;
(2)Na和Cl在周期表第三周期,原子半径Na>Cl,H在周期表第一周期,原子半径最小,则有Na>Cl>H,
故答案为:Na>Cl>H;
(3)C为Na,长期暴露与空气中最终生成Na2CO3,故答案为:Na2CO3;
(4)由以上分析可知H为SiO2,在高温下与碳反应,反应的方程式为2C+SiO2 Si+2CO,若转移4mol电子参加反应的碳为2mol,
Si+2CO,若转移4mol电子参加反应的碳为2mol,
故答案为:SiO2;2;
(5)反应①为Cl2和NaOH反应生成NaCl和NaClO,离子方程式为Cl2+2OHˉ=Clˉ+ClOˉ+H2O,
故答案为:Cl2+2OHˉ=Clˉ+ClOˉ+H2O;
(6)反应②为Na2SiO3和盐酸的反应,反应的化学方程式为Na2SiO3+2HCl=H2SiO3↓+2NaCl,
故答案为:Na2SiO3+2HCl=H2SiO3↓+2NaCl.
分析:A是海水中含量最丰富的盐,应为NaCl,电解生成Na和Cl2,B是常见的无色液体,应为H2O,则A和B的电解应为电解饱和食盐水,生成Cl2、H2和NaOH,F在D中燃烧发出苍白色火焰,则F为H2,D为Cl2,C为Na,E为NaOH,G为HCl,H可用于制造光导纤维,应为SiO2,则I为Na2SiO3,J是一种乳白色凝胶状沉淀,为H2SiO3,Cl2和NaOH反应生成NaCl和NaClO,K为NaCl和NaClO的混合物,结合物质的性质以及题目要求和解答该题.
点评:本题考查无机物的推断,答题时注意分析题目所给信息,根据物质的用途、性质以及反应的典型现象为突破口进行推断,明确物质的种类为解答该题的关键,题目难度中等.
(1)由以上分析可知A为NaCl,为离子化合物,电子式为
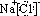 ,D为Cl2,Cl元素在周期表中的位置是第三周期ⅦA族,
,D为Cl2,Cl元素在周期表中的位置是第三周期ⅦA族,故答案为:
 ;第三周期ⅦA族;
;第三周期ⅦA族;(2)Na和Cl在周期表第三周期,原子半径Na>Cl,H在周期表第一周期,原子半径最小,则有Na>Cl>H,
故答案为:Na>Cl>H;
(3)C为Na,长期暴露与空气中最终生成Na2CO3,故答案为:Na2CO3;
(4)由以上分析可知H为SiO2,在高温下与碳反应,反应的方程式为2C+SiO2
 Si+2CO,若转移4mol电子参加反应的碳为2mol,
Si+2CO,若转移4mol电子参加反应的碳为2mol,故答案为:SiO2;2;
(5)反应①为Cl2和NaOH反应生成NaCl和NaClO,离子方程式为Cl2+2OHˉ=Clˉ+ClOˉ+H2O,
故答案为:Cl2+2OHˉ=Clˉ+ClOˉ+H2O;
(6)反应②为Na2SiO3和盐酸的反应,反应的化学方程式为Na2SiO3+2HCl=H2SiO3↓+2NaCl,
故答案为:Na2SiO3+2HCl=H2SiO3↓+2NaCl.
分析:A是海水中含量最丰富的盐,应为NaCl,电解生成Na和Cl2,B是常见的无色液体,应为H2O,则A和B的电解应为电解饱和食盐水,生成Cl2、H2和NaOH,F在D中燃烧发出苍白色火焰,则F为H2,D为Cl2,C为Na,E为NaOH,G为HCl,H可用于制造光导纤维,应为SiO2,则I为Na2SiO3,J是一种乳白色凝胶状沉淀,为H2SiO3,Cl2和NaOH反应生成NaCl和NaClO,K为NaCl和NaClO的混合物,结合物质的性质以及题目要求和解答该题.
点评:本题考查无机物的推断,答题时注意分析题目所给信息,根据物质的用途、性质以及反应的典型现象为突破口进行推断,明确物质的种类为解答该题的关键,题目难度中等.

练习册系列答案
 高效智能课时作业系列答案
高效智能课时作业系列答案 捷径训练检测卷系列答案
捷径训练检测卷系列答案
相关题目
 在如图所示的有关物质转化关系中,各物质均是我们中学化学所学的物质.C为一种黑色粉末,D为一种气体.请根据框图中物质的转化关系及相关信息,用化学式填写下列空白:
在如图所示的有关物质转化关系中,各物质均是我们中学化学所学的物质.C为一种黑色粉末,D为一种气体.请根据框图中物质的转化关系及相关信息,用化学式填写下列空白: (2013?河东区二模)在如图所示的物质转化关系中,A是海水中含量最丰富的盐,B是常见的无色液体,F在D中燃烧发出苍白色火焰.H可用于制造光导纤维,J是一种乳白色凝胶状沉淀.(部分生成物和部分反应条件未列出)
(2013?河东区二模)在如图所示的物质转化关系中,A是海水中含量最丰富的盐,B是常见的无色液体,F在D中燃烧发出苍白色火焰.H可用于制造光导纤维,J是一种乳白色凝胶状沉淀.(部分生成物和部分反应条件未列出)
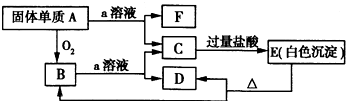 在如图所示的物质相互转化关系中,A是一种固体单质,E是一种白色不溶于水的物质.据此填空.
在如图所示的物质相互转化关系中,A是一种固体单质,E是一种白色不溶于水的物质.据此填空.