题目内容
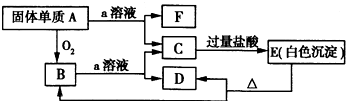 在如图所示的物质相互转化关系中,A是一种固体单质,E是一种白色不溶于水的物质.据此填空.
在如图所示的物质相互转化关系中,A是一种固体单质,E是一种白色不溶于水的物质.据此填空.
(1)写出各物质的化学式:
A______、B______、C______、
D______、E______、F______.
(2)B与a溶液反应的离子方程式是______.
(3)A与a溶液反应的离子方程式是______.
解:C中加入过量HCl产生不溶于盐酸的白色沉淀,推知E可能是硅酸A可能是Si,代入题目验证,a溶液是强碱(如NaOH)溶液或HF溶液,而Si和SiO2与NaOH溶液反应均生成Na2SiO3.Na2SiO3与过量盐酸反应生成NaCl和H2SiO3白色沉淀:H2SiO3 SiO2+H2O,与题意相符.Si和SiO2与HF溶液反应均生成SiF4,SiF4与盐酸不反应.因此A是
SiO2+H2O,与题意相符.Si和SiO2与HF溶液反应均生成SiF4,SiF4与盐酸不反应.因此A是
Si,B是SiO2,C是Na2SiO3(或K2SiO3),D是H2O,E是H2SiO3,F是H2,a是NaOH(或KOH),
(1)由以上分析可知A是Si,B是SiO2,C是Na2SiO3(或K2SiO3),D是H2O,E是H2SiO3,F是H2,故答案为:Si;SiO2;Na2SiO3(或K2SiO3);H2O;H2SiO3;H2;
(2)SiO2与NaOH(或KOH)溶液反应的离子方程式是SiO2+2OH-=SiO32-+H2O,故答案为:SiO2+2OH-=SiO32-+H2O;
(3)Si与NaOH(或KOH)溶液反应的离子方程式是Si+2OH-+H2O=SiO32+2H2↑,故答案为:Si+2OH-+H2O=SiO32+2H2↑.
分析:根据题给信息和框图,B是A的氧化物,本题“突破口”是C中加入过量HCl产生不溶于盐酸的白色沉淀,推知E可能是硅酸A可能是Si,代入题目验证,a溶液是强碱(如NaOH)溶液或HF溶液,而Si和SiO2与NaOH溶液反应均生成Na2SiO3.Na2SiO3与过量盐酸反应生成NaCl和H2SiO3白色沉淀:H2SiO3 SiO2+H2O,与题意相符.Si和SiO2与HF溶液反应均生成SiF4,SiF4与盐酸不反应.因此A是Si,B是SiO2,C是Na2SiO3(或K2SiO3),D是H2O,E是H2SiO3,F是H2,a是NaOH(或KOH),以此解答该题.
SiO2+H2O,与题意相符.Si和SiO2与HF溶液反应均生成SiF4,SiF4与盐酸不反应.因此A是Si,B是SiO2,C是Na2SiO3(或K2SiO3),D是H2O,E是H2SiO3,F是H2,a是NaOH(或KOH),以此解答该题.
点评:本题考查无机物的推断,解答本题的关键是A为固体单质,E为白色沉淀,本题的突破口是C加入过量盐酸生成白色沉淀E,容易想到E为H2SiO3,题目难度不大.
 SiO2+H2O,与题意相符.Si和SiO2与HF溶液反应均生成SiF4,SiF4与盐酸不反应.因此A是
SiO2+H2O,与题意相符.Si和SiO2与HF溶液反应均生成SiF4,SiF4与盐酸不反应.因此A是Si,B是SiO2,C是Na2SiO3(或K2SiO3),D是H2O,E是H2SiO3,F是H2,a是NaOH(或KOH),
(1)由以上分析可知A是Si,B是SiO2,C是Na2SiO3(或K2SiO3),D是H2O,E是H2SiO3,F是H2,故答案为:Si;SiO2;Na2SiO3(或K2SiO3);H2O;H2SiO3;H2;
(2)SiO2与NaOH(或KOH)溶液反应的离子方程式是SiO2+2OH-=SiO32-+H2O,故答案为:SiO2+2OH-=SiO32-+H2O;
(3)Si与NaOH(或KOH)溶液反应的离子方程式是Si+2OH-+H2O=SiO32+2H2↑,故答案为:Si+2OH-+H2O=SiO32+2H2↑.
分析:根据题给信息和框图,B是A的氧化物,本题“突破口”是C中加入过量HCl产生不溶于盐酸的白色沉淀,推知E可能是硅酸A可能是Si,代入题目验证,a溶液是强碱(如NaOH)溶液或HF溶液,而Si和SiO2与NaOH溶液反应均生成Na2SiO3.Na2SiO3与过量盐酸反应生成NaCl和H2SiO3白色沉淀:H2SiO3
 SiO2+H2O,与题意相符.Si和SiO2与HF溶液反应均生成SiF4,SiF4与盐酸不反应.因此A是Si,B是SiO2,C是Na2SiO3(或K2SiO3),D是H2O,E是H2SiO3,F是H2,a是NaOH(或KOH),以此解答该题.
SiO2+H2O,与题意相符.Si和SiO2与HF溶液反应均生成SiF4,SiF4与盐酸不反应.因此A是Si,B是SiO2,C是Na2SiO3(或K2SiO3),D是H2O,E是H2SiO3,F是H2,a是NaOH(或KOH),以此解答该题.点评:本题考查无机物的推断,解答本题的关键是A为固体单质,E为白色沉淀,本题的突破口是C加入过量盐酸生成白色沉淀E,容易想到E为H2SiO3,题目难度不大.

练习册系列答案
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案
相关题目
 元素及其化合物是中学化学的主干知识,我们在整理元素化合物之间的相互转化时,发现有些物质间存在如图所示的三角转化关系(部分反应物或生成物已略去):
元素及其化合物是中学化学的主干知识,我们在整理元素化合物之间的相互转化时,发现有些物质间存在如图所示的三角转化关系(部分反应物或生成物已略去):