题目内容
【题目】已知Ca(OH)2、CaCO3和Ca(HCO3)2都是电解质,进行如图所示的实验,请将实验现象填入下表中的空格处。
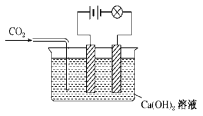
实验操作 | 灯泡亮度变化 |
(1)通入CO2之前 | 亮 |
(2)开始通入CO2时 | |
(3)恰好完全沉淀 | |
(4)沉淀完全后,继续通入过量CO2 | |
(5)再通入CO2 |
【答案】(2)由亮变暗
(3)熄灭
(4)又变亮
(5)明亮程度与操作前几乎不变
【解析】通CO2之前溶液中含有Ca(OH)2电离产生的Ca2+、OH-,灯泡亮;通入CO2发生反应CO2+Ca(OH)2![]() CaCO3↓+H2O,溶液中自由移动的离子减少灯泡由亮变暗;当CO2与Ca(OH)2恰好反应时,溶液中的离子很少,灯泡熄灭;当沉淀完全后,继续通入过量CO2,发生反应CO2+H2O+CaCO3
CaCO3↓+H2O,溶液中自由移动的离子减少灯泡由亮变暗;当CO2与Ca(OH)2恰好反应时,溶液中的离子很少,灯泡熄灭;当沉淀完全后,继续通入过量CO2,发生反应CO2+H2O+CaCO3![]() Ca(HCO3)2,Ca(HCO3)易溶于水,且能电离出Ca2+、
Ca(HCO3)2,Ca(HCO3)易溶于水,且能电离出Ca2+、
HCO3-,溶液又变亮;再通入CO2,溶液中离子浓度几乎不变,灯泡明亮程度与操作前几乎不变。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目