题目内容
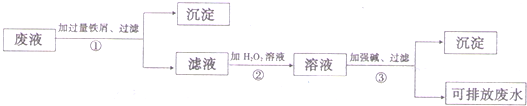
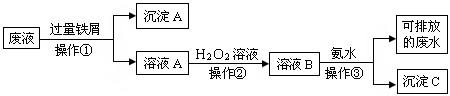
化学实验室产生的废液中含有大量会污染环境的物质,为了保护环境,这些废液必须经处理后才能排放.某化学实验室产生的酸性废液中含有两种金属离子:Fe3+、Cu2+,化学小组设计了如下图所示的方案对废液进行处理,以回收金属,保护环境.

(1)操作①的名称是______.
(2)沉淀A中含有的金属单质有______.
(3)操作②中观察到的实验现象是______.
(4)检验溶液B中含有的金属阳离子常用的试剂是______.
(5)操作③中发生反应生成沉淀C的离子方程式为______.
解:(1)操作①加入的过量的铁,由于铁的化学性质比铜都活泼,因此可以把金属铜从盐溶液中置换出来,同时Fe3+能氧化单质铁生成Fe2+,因此在第①得到的滤渣中都含有金属铜和过量的铁,通过过滤得到沉淀和溶液,
故答案为:过滤;
(2)在第①得到的滤渣中都含有金属铜和过量的铁,通过过滤得到沉淀A和溶液A,因此沉淀A中含有金属单质铜、铁,
故答案为:铜、铁;
(3)Fe2+能被过氧化氢生成Fe3+,溶液由浅绿色变为棕黄色,生成的Fe3+,能加快过氧化氢的分解,有少量气泡出现,
故答案为:溶液由浅绿色变为棕黄色,有少量气泡出现;
(4)根据(3)Fe2+能被过氧化氢生成Fe3+,溶液B中含有的金属阳离子为Fe3+,由于Fe3+遇SCN-离子,发生反应:Fe3++3SCN-=Fe(SCN)3,溶液呈血红色,所以溶液中滴入KSCN溶液后变红,说明该溶液中含有Fe3+,检验溶液B中含有的金属阳离子常用的试剂是KSCN溶液,
故答案为:KSCN溶液;
(5)溶液B中含有的金属阳离子为Fe3+,稀氨水中存在下述电离平衡:NH3+H2O?NH3?H2O?NH4++OH-,溶液B中加氨水,发生Fe3++3NH3?H2O=Fe(OH)3↓+3NH4+,
故答案为:Fe3++3NH3?H2O=Fe(OH)3↓+3NH4+;
分析:(1)操作①加入的过量的铁屑,在第①得到的滤渣中含有金属铜和过量的铁,需过滤得到沉淀A和溶液A;
(2)操作①加入的过量的铁屑,由于铁的化学性质比铜都活泼,因此可以把金属铜从盐溶液中置换出来,同时Fe3+能氧化单质铁生成Fe2+,因此在第①得到的滤渣中都含有金属铜和过量的铁;
(3)根据Fe2+能被过氧化氢生成Fe3+,溶液由浅绿色变为棕黄色,生成的Fe3+,能加快过氧化氢的分解,有少量气泡出现;
(4)根据(3)Fe2+能被过氧化氢生成Fe3+,溶液B中含有的金属阳离子为Fe3+,Fe3+遇KSCN溶液变为血红色,作为检验Fe3+的特征试剂;
(5)溶液B中含有的金属阳离子为Fe3+,加氨水生成氢氧化铁沉淀;
点评:本题考查离子的分离,物质的回收,掌握离子之间的反应、离子的性质是解答的关键,题目难度不大.
故答案为:过滤;
(2)在第①得到的滤渣中都含有金属铜和过量的铁,通过过滤得到沉淀A和溶液A,因此沉淀A中含有金属单质铜、铁,
故答案为:铜、铁;
(3)Fe2+能被过氧化氢生成Fe3+,溶液由浅绿色变为棕黄色,生成的Fe3+,能加快过氧化氢的分解,有少量气泡出现,
故答案为:溶液由浅绿色变为棕黄色,有少量气泡出现;
(4)根据(3)Fe2+能被过氧化氢生成Fe3+,溶液B中含有的金属阳离子为Fe3+,由于Fe3+遇SCN-离子,发生反应:Fe3++3SCN-=Fe(SCN)3,溶液呈血红色,所以溶液中滴入KSCN溶液后变红,说明该溶液中含有Fe3+,检验溶液B中含有的金属阳离子常用的试剂是KSCN溶液,
故答案为:KSCN溶液;
(5)溶液B中含有的金属阳离子为Fe3+,稀氨水中存在下述电离平衡:NH3+H2O?NH3?H2O?NH4++OH-,溶液B中加氨水,发生Fe3++3NH3?H2O=Fe(OH)3↓+3NH4+,
故答案为:Fe3++3NH3?H2O=Fe(OH)3↓+3NH4+;
分析:(1)操作①加入的过量的铁屑,在第①得到的滤渣中含有金属铜和过量的铁,需过滤得到沉淀A和溶液A;
(2)操作①加入的过量的铁屑,由于铁的化学性质比铜都活泼,因此可以把金属铜从盐溶液中置换出来,同时Fe3+能氧化单质铁生成Fe2+,因此在第①得到的滤渣中都含有金属铜和过量的铁;
(3)根据Fe2+能被过氧化氢生成Fe3+,溶液由浅绿色变为棕黄色,生成的Fe3+,能加快过氧化氢的分解,有少量气泡出现;
(4)根据(3)Fe2+能被过氧化氢生成Fe3+,溶液B中含有的金属阳离子为Fe3+,Fe3+遇KSCN溶液变为血红色,作为检验Fe3+的特征试剂;
(5)溶液B中含有的金属阳离子为Fe3+,加氨水生成氢氧化铁沉淀;
点评:本题考查离子的分离,物质的回收,掌握离子之间的反应、离子的性质是解答的关键,题目难度不大.

练习册系列答案
相关题目