题目内容
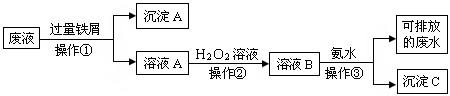
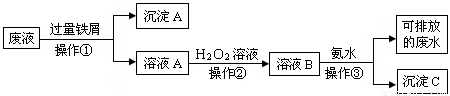
化学实验室产生的废液中含有大量会污染环境的物质,为了保护环境,化学实验室里的废液必须经处理后才能排放.某化学实验室里的废液中含有Fe3+、Cu2+、Ag+三种金属离子,实验室设计了下列方案对废液进行处理: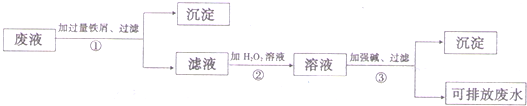
(1)废液经操作①得到的沉淀中含有的金属单质是
(2)在操作②中所观察到的实验现象是
(3)操作③中所发生反应的离子方程式为
分析:(1)操作①加入的过量的铁屑,由于铁的化学性质比铜、银都活泼,因此可以把金属铜、银从盐溶液中置换出来,同时Fe3+能氧化单质铁生成Fe2+,因此在第①得到的滤渣中都含有金属铜、银和过量的铁;
(2)根据Fe2+能被过氧化氢生成Fe3+,溶液由浅绿色变为黄色进行解答;
(3)根据滤液中Fe2+能被过氧化氢生成Fe3+,加入双氧水后的溶液中含有的金属阳离子为Fe3+,加入强碱溶液后生成氢氧化铁沉淀.
(2)根据Fe2+能被过氧化氢生成Fe3+,溶液由浅绿色变为黄色进行解答;
(3)根据滤液中Fe2+能被过氧化氢生成Fe3+,加入双氧水后的溶液中含有的金属阳离子为Fe3+,加入强碱溶液后生成氢氧化铁沉淀.
解答:解:(1)废液中含有Fe3+、Cu2+、Ag+三种金属离子,加入过量的铁粉后,铜离子、银离子被还原成金属铜、银和铁粉,所以在第①得到的沉淀中含有金属铜、银和过量的铁,
故答案为:铜、银、铁;
(2)Fe2+能被过氧化氢生成Fe3+,溶液由浅绿色变为黄色,
故答案为:溶液由浅绿色变为黄色;
(3)滤液中含有亚铁离子,加入双氧水后溶液中亚铁离子氧化成铁离子,铁离子与氢氧根离子反应生成氢氧化铁沉淀,反应的离子方程式为Fe3++3OH-=Fe(OH)3↓,
故答案为:Fe3++3OH-=Fe(OH)3↓.
故答案为:铜、银、铁;
(2)Fe2+能被过氧化氢生成Fe3+,溶液由浅绿色变为黄色,
故答案为:溶液由浅绿色变为黄色;
(3)滤液中含有亚铁离子,加入双氧水后溶液中亚铁离子氧化成铁离子,铁离子与氢氧根离子反应生成氢氧化铁沉淀,反应的离子方程式为Fe3++3OH-=Fe(OH)3↓,
故答案为:Fe3++3OH-=Fe(OH)3↓.
点评:本题考查了金属的回收与环境保护,题目难度中等,注意掌握金属回收方法、常见的离子之间的反应,明确离子方程式的书写方法,试题培养了学生灵活应用所学知识的能力.

练习册系列答案
 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案 期末金牌卷系列答案
期末金牌卷系列答案 轻松课堂标准练系列答案
轻松课堂标准练系列答案
相关题目