题目内容
(20分)
18-I(6分)已知: ,如果要合成
,如果要合成 所用的原始原料可以是
所用的原始原料可以是
A. 2-甲基-l,3-丁二烯和2-丁炔 B.1,3-戊二烯和2-丁炔
C.2,3-二甲基-1,3-戊二烯和乙炔 D、2,3-二甲基-l,3-丁二烯和丙炔
18-II(14分)A~G都是有机化合物,它们的转化关系如下:
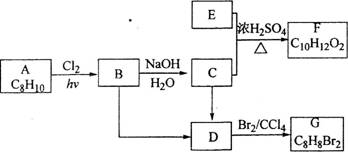
请回答下列问题:
(1)已知:6.0g化合物E完全燃烧生成8.8g C02和3.6g H20;E的蒸气与氢气的相对密度为30,则E的分子式为_______________:[来源:ZXXK]
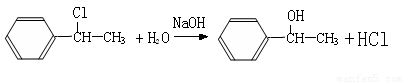
(2)A为一取代芳烃,B中含有一个甲基。由B生成C的化学方程式为_______________;
(3)由B生成D、由C生成D的反应条件分别是_______________、_______________;
(4)由A生成B、由D生成G的反应类型分别是_______________、_______________;
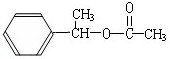
(5) F存在于栀子香油中,其结构简式为_______________;
(6)在G的同分异构体中,苯环上一硝化的产物只有一种的共有___________个,其中核磁共
振氢谱有两组峰,且峰面积比为l:1的是_______________ (填结构简式)。
18-I A、D
18-II
(1)C2H4O2
(2)
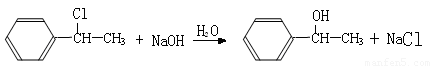
(3)NaOH的醇溶液、加热;浓硫酸、一定温度下
(4)取代反应、加成反应
(5)
(6)7种;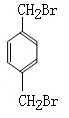
【解析】

草酸亚铁(FeC2O4•2H2O)用作分析试剂及显影剂和新型电池材料磷酸亚铁锂的生产。已知:CO能与氯化钯(PdCl2)溶液反应生成黑色的钯粉。回答下列问题:
I.兴趣小组对草酸亚铁的分解产物进行实验和探究。
(1)将气体产物依次通过A、澄清石灰水,B、氯化钯,观察到A中澄清石灰水都变浑浊,B中出现黑色物质生成,则上述现象说明气体产物中有 。
(2)探究分解得到的固体产物中铁元素的存在形式。
①提出假设
假设1:________; 假设2:FeO; 假设3:FeO和Fe混合物
②设计实验方案证明假设3。
限选试剂: 1.0 mol•L-1盐酸、3% H2O2、0.1 mol•L-1CuSO4、20% KSCN、蒸馏水。
|
实验步骤 |
现象与结论 |
|
步骤1 :向试管中加入少量固体产物,再加入足量_________________,充分振荡 |
若溶液颜色明显改变,且有_______生成,则证明有铁单质存在 |
|
步骤2: 将步骤1中得到的浊液过滤,并用蒸馏水洗涤至洗涤液无色 |
|
|
步骤3:取步骤2得到的少量固体与试管中, 滴加___________________________________ _______________________________________
|
__________________________________ ___________________________________
|
II.某草酸亚铁样品中含有少量草酸(为方便于计算,草酸亚铁中草酸根和草酸分子均用C2O42-代替)。现用滴定法测定该样品中FeC2O4的含量。滴定反应分别是:5Fe2++MnO4-+8H+=5Fe3+ +Mn2++4H2O、5C2O42-+2MnO4-+16H+=10CO2↑+2Mn2++8H2O。
(3)实验方案设计为:
①将准确称量的0.20g草酸亚铁样品置于250 mL锥形瓶内,加入适量2 mol/L的H2SO4溶液,使样品溶解,加热至70℃左右,立即用浓度为0.02000 mol/L的高锰酸钾标准溶液滴定至终点,记录数据。重复滴定2次。平均消耗V1 mL。
②向上述滴定混合液中加入适量的Zn粉和过量的2 mol/L的H2SO4溶液,煮沸5~8min,用KSCN溶液在点滴板上检验点滴液,直至溶液不立刻变红。将滤液过滤至另一个锥形瓶中,继续用0.02000 mol/L的高锰酸钾标准溶液滴定至终点,记录数据。重复滴定2次。平均消耗V2 mL。
③若某小组的一次测定数据记录如下: V1= 18.90mL,V2=6.20mL。根据数据计算0.20g 样品中:n(Fe2+)= ; n(C2O42-)= ;FeC2O4 的质量分数为 (精确到0.01%,FeC2O4的式量为144)
已知:N2(g)+3H2(g)![]() 2NH3(g)△H=-92.4kJ/mol,这是目前普遍使用的人工固氮的方法。请回答下列问题:
2NH3(g)△H=-92.4kJ/mol,这是目前普遍使用的人工固氮的方法。请回答下列问题:
(1)450℃时,往一个2L的密闭容器中充入2. 6mol H2和1mol N2, 反应过程中对NH3的浓度进行检测,得到的数据如下表所示:
| 时间/min | 5 | 10 | 15 | 20 | 25 | 30 |
| c(NH3)/mol·L—1 | 0.08 | 0.14 | 0.18 | 0.20 | 0.20 | 0.20 |
①此条件下该反应的化学平衡常数K=_______________;反应达到平衡后,若往平衡体系中加入H2、N2和NH3各2mol,此时该反应的v(N2)正_______________v(N2)逆(填写“>”、“=”或“<”=)。
②若改变某一条件,达新平衡时n(H2)=1.60mol ,下列说法正确的是_____________。
A.平衡一定正向移动 B.可能是向容器中加入了一定量的H2气体
C.可能是降低了容器的温度 D.可能是缩小了容器的体积
(2)450℃时,在另一密闭容器中进行上述合成氨的反应,各物质的起始浓度和平衡浓度如下表所示:
| N2 | H2 | NH3 | |
| 起始浓度(mol/L) | 0.2 | 0.3 | 0.2 |
| 平衡浓度(mol/L) | a | b | c |
请回答:
①a的取值范围是:_______________.
②请用数学表达式表示下列量之间的关系:
(I)a与b的关系:_______________。(Ⅱ)a、b、c的关系:_______________。
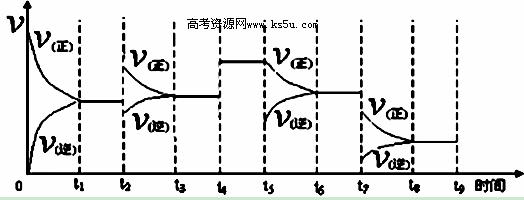
③反应达到平衡后,改变某一外界条件,反应速率与时间的关系如下图所示,其中t2﹑t7时刻所对应的实验条件改变分别是:t2 ;t7 。
 ,如果要合成
,如果要合成 所用的原始原料可以是
所用的原始原料可以是
 F存在于栀子香油中,其结构简式为_______________;
F存在于栀子香油中,其结构简式为_______________;