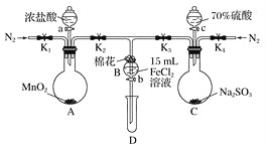
题目内容
【题目】弱酸H2A溶液中,存在H2A、HA-和A2-三种形态的粒子,其物质的量分数δ(X)随溶液pH变化的关系如图所示[已知δ(X)=![]() ],下列说法不正确的是(图中:a=1.25、b=4.27)
],下列说法不正确的是(图中:a=1.25、b=4.27)

A. 已知pKa=-lgKa,则pKa1=1.25
B. 0.1mol·L-1的NaHA溶液显碱性
C. 0.1mol·L-1Na2A溶液中:2c(H2A)+c(HA-)=c(OH-)-c(H+)
D. 0.1mol·L-1NaHA溶液中:c(Na+)+c(A2-)+c(H2A)+c(HA-)=0.2mol·L-1
【答案】B
【解析】a点c(HA-)= c(H2A),PH=1.25,c(H+)=10-1.25,则![]() ,所以pKa=-lgKa=1.25,故A正确;b点c(HA-)= c(A2-),PH=4.27,c(H+)=10-4.27,则
,所以pKa=-lgKa=1.25,故A正确;b点c(HA-)= c(A2-),PH=4.27,c(H+)=10-4.27,则![]() ,所以HA-的电离平衡常数是10-4.27,水解平衡常数是
,所以HA-的电离平衡常数是10-4.27,水解平衡常数是![]() ,电离大于水解,所以0.1mol·L-1的NaHA溶液显酸性,故B错误;根据质子守恒,0.1mol·L-1Na2A溶液中:2c(H2A)+c(HA-)+c(H+)=c(OH-),故C正确;根据物料守恒,c(Na+)=c(A2-)+c(H2A)+c(HA-)=0.1mol·L-1,所以c(Na+)+c(A2-)+c(H2A)+c(HA-)=0.2mol·L-1,故D正确。
,电离大于水解,所以0.1mol·L-1的NaHA溶液显酸性,故B错误;根据质子守恒,0.1mol·L-1Na2A溶液中:2c(H2A)+c(HA-)+c(H+)=c(OH-),故C正确;根据物料守恒,c(Na+)=c(A2-)+c(H2A)+c(HA-)=0.1mol·L-1,所以c(Na+)+c(A2-)+c(H2A)+c(HA-)=0.2mol·L-1,故D正确。

【题目】下列反应既属于氧化还原反应,又属于生成物的总能量大于反应物的总能量的是( )
A.Ba(OH)2·8H2O 与 NH4Cl 的反应B.碳与二氧化碳的反应
C.铝片和稀盐酸反应D.甲烷在氧气中的燃烧
【题目】如图所示,p、q为直流电源的两极,A由金属单质X制成,B、C、D为铂电极,接通电源,金属X沉积于B极,同时C、D上产生气泡,试回答: 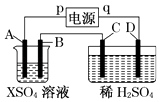
(1)p为极,A极发生了反应.
(2)C为极,可收集到;D为极,可收集到 .
(3)C极的电极反应式为 .
(4)在电解过程中,测C、D两极上产生气体的体积,实验数据如表:
时间(min) | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
阴极产生气体的体积(cm3) | 6 | 12 | 20 | 29 | 39] | 49 | 59 | 69 | 79 | 89 |
阳极产生气体的体积(cm3) | 2 | 4 | 7 | 11 | 16 | 21 | 26 | 31 | 36 | 41 |
仔细分析以上实验数据,请说出变化的可能原因是 .
(5)当反应进行一段时间后,A、B电极附近溶液的pH(填“增大”“减小”或“不变”).
(6)当电路中通过0.004mol电子时,B极上沉积的金属X为0.128g,则此金属的摩尔质量为 .