题目内容
【题目】关于下列图象的说法正确的是( )[注:E﹣能量,p﹣压强,t﹣时间,V﹣体积] 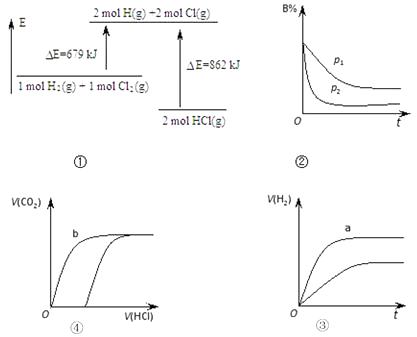
A.①表示化学反应H2(g)+Cl2(g)=2HCl(g)的能量变化,则该反应的反应热△H=183 kJ/mol
B.②表示其它条件不变时,反应 4A(g)+3B(g)2C(g)+6D在不同压强下 B的体积分数随时间的变化,则D一定是气体
C.③表示体积和pH均相同的HCl和CH3COOH两种溶液中,分别加入足量的锌,产生H2的体积随时间的变化,则a曲线表示CH3COOH溶液
D.④表示分别向同为10 mL 0.1mol/L Na2CO3和NaHCO3两种溶液中,逐滴滴加0.1mol/L 盐酸,所产生CO2的体积随盐酸体积的变化情况,则b曲线表示Na2CO3溶液
【答案】C
【解析】解:A、分析图象拆化学键和形成化学键能量变化判断,反应是放热反应;反应热△H=﹣183kJ/mol;故A错误;
B、先拐先平压强大,P2>P1 , 压强越大B的含量越小,平衡正向进行,正向是气体体积减小的反应,D一定不是气体;故B错误;
C、醋酸是弱酸存在电离平衡,体积和pH均相同的HCl和CH3COOH两种溶液中加入过量锌,醋酸溶液中生成氢气多;故C正确;
D、碳酸钠溶液中滴入盐酸开始无气体生成,滴入到碳酸钠反应为碳酸氢钠时,再加入盐酸会生成气体,碳酸氢钠溶液中滴入盐酸生成气体,b为碳酸氢钠;故D错误;
故选C.
【考点精析】认真审题,首先需要了解反应热和焓变(在化学反应中放出或吸收的热量,通常叫反应热),还要掌握化学平衡状态本质及特征(化学平衡状态的特征:“等”即 V正=V逆>0;“动”即是动态平衡,平衡时反应仍在进行;“定”即反应混合物中各组分百分含量不变;“变”即条件改变,平衡被打破,并在新的条件下建立新的化学平衡;与途径无关,外界条件不变,可逆反应无论是从正反应开始,还是从逆反应开始,都可建立同一平衡状态(等效))的相关知识才是答题的关键.

 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案 快乐暑假暑假能力自测中西书局系列答案
快乐暑假暑假能力自测中西书局系列答案