题目内容
CuSO4溶液是中学化学及工农业生产中常见的一种试剂。
(1)某同学配制CuSO4溶液时,向盛有一定量硫酸铜晶体的烧杯中加入适量的蒸馏水,并不断搅拌,结果得到悬浊液。他认为是固体没有完全溶解,于是对悬浊液加热,结果发现浑浊更明显了,随后,他向烧杯中加入了一定量的 溶液,得到了澄清的CuSO4溶液。
(2)该同学利用制得的CuSO4溶液,进行以下实验探究。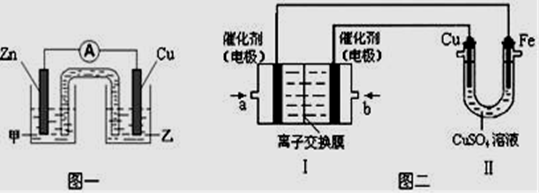
①图一是根据反应Zn + CuSO4== Cu + ZnSO4设计成的锌铜原电池。Cu极的电极反应式是 ,盐桥中是含有琼胶的KCl饱和溶液,电池工作时K+向 移动(填“甲”或“乙”)。
②图二中,Ⅰ是甲烷燃料电池(电解质溶液为KOH溶液)的结构示意图,该同学想在Ⅱ中实现铁上镀铜,则b处通入的是 (填“CH4”或“O2”),a处电极上发生的电极反应式是 ;当铜电极的质量减轻3.2g,则消耗的CH4在标准状况下的体积为 L。
(3)反应一段时间后,燃料电池的电解质溶液完全转化为K2CO3溶液,以下关系正确的是 。
| A.c(K+)+c(H+)=c(HCO3-)+ c(CO32-)+c(OH-) |
| B.c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3) |
| C.c(K+)>c(CO32-)>c(H+)>c(OH-) |
| D.c(K+)>c(CO32-)>c(OH-)>c(HCO3-) |
(1)硫酸;
(2)①Cu2++2e-═Cu;乙;
②O2;CH4-8e-+10OH-=CO32-+7H2O;0.28L;
(3)BD.
解析试题分析:(1)硫酸铜水解生成氢氧化铜而使溶液浑浊,加少量硫酸抑制硫酸铜水解。(2)图一中Zn是负极、Cu是正极。Cu极电极反应为Cu2++2e-=Cu。盐桥中阳离子向正极迁移。图二中左边是燃料电池,右边是电解池。要实现铁上镀铜,则铁作阴极,铜作阳极,所以a处通CH4、b处通O2。A处电极反应为CH4-8e-+10OH-=CO32-+7H2O。4Cu~8e-~CH4,所以当铜溶解0.05mol时,消耗CH40.0125mol。(3)碳酸钾溶液中电荷守恒式为c(K+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-),A错误;物料守恒式为c(K+)= 2c(CO32-)+ 2c(HCO3-)+2c(H2CO3),E错误;将电荷守恒与物料守恒相减消去c(K+)得c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3),B正确;K2CO3溶液中CO32-+H2O HCO3-+ OH-、HCO3-+H2O
HCO3-+ OH-、HCO3-+H2O H2CO3+OH-,离子浓度大小关系为c(K+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+),D正确、C错误。
H2CO3+OH-,离子浓度大小关系为c(K+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+),D正确、C错误。
考点:盐类的水解 电化学 离子浓度比较
点评:电解池中与电源正极相连的是阳极、与电源负极相连的是阴极;串联电路中电流强度处处相等,每个电极上转移电子数相等。

 同步轻松练习系列答案
同步轻松练习系列答案 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案
 Cu(OH)2+2H+
Cu(OH)2+2H+


 将增大
将增大