题目内容
黄铜矿是工业炼铜的主要原料,其主要成分为CuFeS2,现有一种天然黄铜矿(含少量SiO2),为了测定该黄铜矿的纯度,某同学设计了如下实验:

现称取研细的黄铜矿样品1.150g,在空气存在下进行煅烧,生成Cu、Fe3O4和SO2气体,实验后取d中溶液的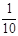 置于锥形瓶中,用0.05mol/L标准碘溶液进行滴定,消耗标准溶液20.00mL。请回答下列问题:
置于锥形瓶中,用0.05mol/L标准碘溶液进行滴定,消耗标准溶液20.00mL。请回答下列问题:
(1)称量样品所用的仪器为_____(填“托盘天平”或“电子天平”),将样品研细后再反应,其目的是_______ 。
(2)装置a和c的作用分别是____和____(填标号)。
a.除去SO2气体
b.除去空气中的水蒸气
c.有利于气体混合
d.有利于观察空气流速
e.除去反应后多余的氧气
(3)上述反应结束后,仍需通一段时间的空气,其目的是___________。
(4)通过计算可知,该黄铜矿的纯度为________。
(5)若用右图装置替代上述实验装置d,同样可以达到实验目的的是____(填序号)。

(6)若将原装置d中的试液改为Ba(OH)2,测得的黄铜矿纯度误差为+1%,假设实验操作均正确,可能的原因主要有_____________________________________________。
(15分)(1)电子天平(2分),使原料充分反应、加快反应速率(2分)。
(2)b、d和e (各1分,共3分)
(3)使反应生成的SO2全部进入d装置中,使结果精确(2分)。
(4)80%(2分)
(5)②(2分)。
(6) 空气中的CO2与Ba(OH)2反应生成BaCO3沉淀;BaSO3被氧化成BaSO4(合理答案均可)(2分)
【解析】
试题分析:(1)托盘天平的精确度为 0.1g,故只有电子天平才能称取1.150g样品;研细的目的是增大固体的表面积,使原料充分反应、加快反应速率;(2)浓硫酸能除去空气中的水蒸气,且洗气瓶有利于观察空气流速;灼热铜网的目的是除去反应后多余的氧气;(3)反应结束后,仍需通入一段时间的空气,其目的是使反应生成的SO2全部进入d装置中,使结果精确;(4)由c•V可知n(I2)=0.05mol/L×20.00×10—3L,由I2+SO2+2H2O=4H++2I—+SO42—可知n(SO2)=n(I2)=0.05mol/L×20.00×10—3L,则总的n(SO2)=0.05mol/L×20.00×10—3L÷1/10,由CuFeS2~2SO2可知,n(CuFeS2)=0.05mol/L×20.00×10—3L÷1/10÷2,由n•M可知m(CuFeS2)=0.05mol/L×20.00×10—3L÷1/10÷2×184g/mol,则其纯度为0.05mol/L×20.00×10—3L÷1/10÷2×184g/mol÷1.150g×100%=80%;(5)SO2不能与BaCl2反应,故①错误;SO2与Ba(NO3)2溶液反应,生成白色的硫酸钡沉淀,过滤、干燥、称取沉淀的质量,可以测定样品的纯度,故②正确;SO2不能与NaHSO3溶液反应,故③错误;(6)空气中的CO2与Ba(OH)2反应生成BaCO3沉淀,BaSO3被氧化成BaSO4,这些因素都可能导致误差。
考点:考查仪器的使用、影响化学反应速率的因素、混合物的分离和提纯、测定样品的纯度、实验目的、误差分析等相关知识。

 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案(08年广东卷)铜在自然界存在于多种矿石中,如:
矿石名称 | 黄铜矿 | 斑铜矿 | 辉铜矿 | 孔雀石 |
主要成分 | CuFeS2 | Cu5FeS4 | Cu2S | CuCO3?Cu(OH)2 |
请回答下列问题:
(1)上表所列铜化合物中,铜的质量百分含量最高的是 。
(2)工业上以黄铜矿为原料。采用火法溶炼工艺生产铜。该工艺的中间过程会发生反应:2Cu2O+Cu2S![]() 6Cu+SO2↑,反应的氧化剂是 。
6Cu+SO2↑,反应的氧化剂是 。
(3)SO2尾气直接排放到大气中造成环境污染的后果是 ;处理该尾气可得到有价值的化学品,写出其中1种酸和1种盐的名称 。
(4)黄铜矿熔炼后得到的粗铜含少量Fe、Ag、Au等金属杂质,需进一步采用电解法精制。请简述粗铜电解得到精铜的大批量: 。
(5)下表中,对陈述Ⅰ、Ⅱ的正确性及其有无因果关系的判断都正确的是 (填字母)。
选项 | 陈述Ⅰ | 陈述Ⅱ | 判断 |
A | 铜绿的主成分是碱酸铜 | 可用稀盐酸除铜器表面的铜绿 | Ⅰ对;Ⅱ 对;有 |
B | 铜表易形成致密的氧化膜 | 铜容器可以盛放浓硫酸 | Ⅰ对;Ⅱ 对;有 |
C | 铁比铜活泼 | 例在铜板上的铁钉在潮湿空气中不易生锈 | Ⅰ对;Ⅱ 对;有 |
D | 蓝色硫酸铜晶体受热转化为白色硫酸铜粉末是物理变化 | 硫酸铜溶液可用作游泳池的消毒剂 | Ⅰ错;Ⅱ 对;无 |
![]()
![]() 铜在自然界存在于多种矿石中,如:
铜在自然界存在于多种矿石中,如:
| 矿石名称 | 黄铜矿 | 斑铜矿 | 辉铜矿 | 孔雀石 |
| 主要成分 | CuFeS2 | Cu5FeS4 | Cu2S | CuCO3·Cu(OH)2 |
请回答下列问题:
(1)上表所列铜化合物中,铜的质量百分含量最高的是 。
(2)工业上以黄铜矿为原料。采用火法溶炼工艺生产铜。该工艺的中间过程会发生反应:2Cu2O+Cu2S![]() 6Cu+SO2↑,反应的氧化剂是 。
6Cu+SO2↑,反应的氧化剂是 。
(3)SO2尾气直接排放到大气中造成环境污染的后果是 ;处理该尾气可得到有价值的化学品,写出其中1种酸和1种盐的名称 。
(4)黄铜矿熔炼后得到的粗铜含少量Fe、Ag、Au等金属杂质,需进一步采用电解法精制。请写出粗铜电解得到精铜的电极反应式:阳极 ;阴极 。
(5)下表中,对陈述Ⅰ、Ⅱ的正确性及其有无因果关系的判断都正确的是 (填字母)。
| 选项 | 陈述Ⅰ | 陈述Ⅱ | 判断 |
| A | 铜绿的主成分是碱酸铜 | 可用稀盐酸除铜器表面的铜绿 | Ⅰ对;Ⅱ对;有 |
| B | 铜表易形成致密的氧化膜 | 铜容器可以盛放浓硫酸 | Ⅰ对;Ⅱ对;有 |
| C | 铁比铜活泼 | 例在铜板上的铁钉在潮湿空气中不易生锈 | Ⅰ对;Ⅱ对;有 |
| D | 蓝色硫酸铜晶体受热转化为白色硫酸铜粉末是物理变化 | 硫酸铜溶液可用作游泳池的消毒剂 | Ⅰ错;Ⅱ对;无 |
(11分)(08年广东化学·22)
铜在自然界存在于多种矿石中,如:
| 矿石名称 | 黄铜矿 | 斑铜矿 | 辉铜矿 | 孔雀石 |
| 主要成分 | CuFeS2 | Cu5FeS4 | Cu2S | CuCO3·Cu(OH)2 |
请回答下列问题:
(1)上表所列铜化合物中,铜的质量百分含量最高的是 。
(2)工业上以黄铜矿为原料。采用火法溶炼工艺生产铜。该工艺的中间过程会发生反应:2Cu2O+Cu2S![]() 6Cu+SO2↑,反应的氧化剂是 。
6Cu+SO2↑,反应的氧化剂是 。
(3)SO2尾气直接排放到大气中造成环境污染的后果是 ;处理该尾气可得到有价值的化学品,写出其中1种酸和1种盐的名称 。
(4)黄铜矿熔炼后得到的粗铜含少量Fe、Ag、Au等金属杂质,需进一步采用电解法精制。请简述粗铜电解得到精铜的原理: 。
(5)下表中,对陈述Ⅰ、Ⅱ的正确性及其有无因果关系的判断都正确的是 (填字母)。
| 选项 | 陈述Ⅰ | 陈述Ⅱ | 判断 |
| A | 铜绿的主成分是碱酸铜 | 可用稀盐酸除铜器表面的铜绿 | Ⅰ对;Ⅱ对;有 |
| B | 铜表易形成致密的氧化膜 | 铜容器可以盛放浓硫酸 | Ⅰ对;Ⅱ对;有 |
| C | 铁比铜活泼 | 例在铜板上的铁钉在潮湿空气中不易生锈 | Ⅰ对;Ⅱ对;有 |
| D | 蓝色硫酸铜晶体受热转化为白色硫酸铜粉末是物理变化 | 硫酸铜溶液可用作游泳池的消毒剂 | Ⅰ错;Ⅱ对;无 |
(9分)铜在自然界存在于多种矿石中,如:
| 矿石名称 | 黄铜矿 | 斑铜矿 | 辉铜矿 | 孔雀石 |
| 主要成分 | CuFeS2 | Cu5FeS4 | Cu2S | CuCO3·Cu(OH)2 |
(1)上表所列铜化合物中,铜的质量百分含量最高的是 。
(2)工业上以黄铜矿为原料。采用火法溶炼工艺生产铜。该工艺的中间过程会发生反应:2Cu2O+Cu2S
 6Cu+SO2↑,反应的氧化剂是 。
6Cu+SO2↑,反应的氧化剂是 。(3)SO2尾气直接排放到大气中造成环境污染的后果是 ;处理该尾气可得到有价值的化学品,写出其中1种酸和1种盐的名称 。
(4)黄铜矿熔炼后得到的粗铜含少量Fe、Ag、Au等金属杂质,需进一步采用电解法精制。请写出粗铜电解得到精铜的电极反应式:阳极 ;阴极 。
(5)下表中,对陈述Ⅰ、Ⅱ的正确性及其有无因果关系的判断都正确的是 (填字母)。
| 选项 | 陈述Ⅰ | 陈述Ⅱ | 判断 |
| A | 铜绿的主成分是碱酸铜 | 可用稀盐酸除铜器表面的铜绿 | Ⅰ对;Ⅱ对;有 |
| B | 铜表易形成致密的氧化膜 | 铜容器可以盛放浓硫酸 | Ⅰ对;Ⅱ对;有 |
| C | 铁比铜活泼 | 例在铜板上的铁钉在潮湿空气中不易生锈 | Ⅰ对;Ⅱ对;有 |
| D | 蓝色硫酸铜晶体受热转化为白色硫酸铜粉末是物理变化 | 硫酸铜溶液可用作游泳池的消毒剂 | Ⅰ错;Ⅱ对;无 |