题目内容
【题目】化学实验有助于理解化学知识,形成化学观念,提高探究与创新能力,提升科学素养。I.在具支试管中加入碎瓷片和无水硫酸铝,用注射器吸取一定量石蜡油,重新连接好装置;点燃酒精灯,加热具支试管中的碎瓷片和无水硫酸铝的混合物约两分钟;将注射器中的石蜡油缓慢、逐次推入具支试管中,石蜡油与灼热的碎瓷片和无水硫酸铝接触,将所得气体依次通入酸性高锰酸钾溶液和溴水中,发现酸性高锰酸钾溶液和溴水均褪色.,将导气管迅速替换成燃烧尖嘴,点燃气体,火焰明亮,有黑烟。
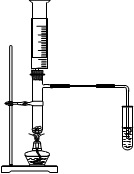
(1)碎瓷片和无水硫酸铝的作用是___________。
(2)通过本实验说明____________________。
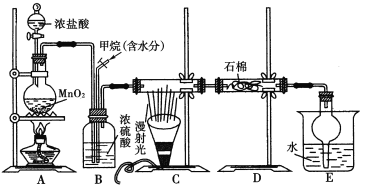
II.实验室可用氯气与金属铁反应制备无水三氯化铁,三氯化铁呈棕红色、易潮解,100![]() 左右时升华。某化学兴趣小组利用下列实验装置制备并收集无水三氯化铁。
左右时升华。某化学兴趣小组利用下列实验装置制备并收集无水三氯化铁。
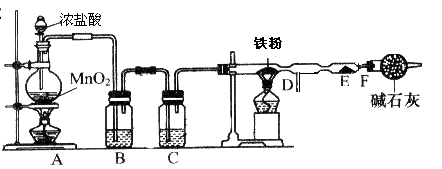
(3)A装置中发生反应的离子方程式为 ;
(4)实验时,先点燃A处的酒精灯,当D管处颜色变黄绿色时,再点燃D处的酒精灯,这样操作是为了 。
(5)B装置中应盛放的试剂名称为 ;
(6)F装置所起的作用是阻止空气中的水进入反应器,防止无水三氯化铁潮解和
【答案】I.(1)催化作用; (2)所得气体含乙烯;II.(3) MnO2 + 4H+ + 2Cl-![]() Mn2+ +Cl2↑+ 2H2O;(4)排除装置中的空气;(5)饱和食盐水;(6)吸收氯气,防止污染空气。
Mn2+ +Cl2↑+ 2H2O;(4)排除装置中的空气;(5)饱和食盐水;(6)吸收氯气,防止污染空气。
【解析】
试题分析:I.(1)碎瓷片和无水硫酸铝的作用是作催化剂,催化石蜡油转变成乙烯;(2)根据实验现象,酸性高锰酸钾溶液和溴水均褪色,说明有乙烯气体存在,即石蜡油中得到的气体中含有乙烯;II.(3)反应装置A制备氯气,其离子反应方程式为MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O;(4)装置中有空气,空气中的氧气在加热条件下和铁粉发生反应,所以先通一段时间的氯气,其目的是排除装置的空气;(5)制备的氯气中含有HCl,可能干扰实验,用饱和食盐水吸收氯气中的HCl,因此B装置盛放的是饱和食盐水;(6)根据信息FeCl3易潮解,因此要防止空气中水蒸气的进入,同时氯气有毒,防止氯气污染空气。
Mn2++Cl2↑+2H2O;(4)装置中有空气,空气中的氧气在加热条件下和铁粉发生反应,所以先通一段时间的氯气,其目的是排除装置的空气;(5)制备的氯气中含有HCl,可能干扰实验,用饱和食盐水吸收氯气中的HCl,因此B装置盛放的是饱和食盐水;(6)根据信息FeCl3易潮解,因此要防止空气中水蒸气的进入,同时氯气有毒,防止氯气污染空气。