题目内容
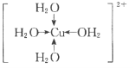
【题目】1915年诺贝尔物理学奖授予Henry Bragg和Lawrence Bragg,以表彰他们用X射线对晶体结构的分析所作的贡献。科学家通过X射线推测胆矾中既含有配位键,又含有氢键,其结构示意图可简单表示如图,其中配位键和氢键均釆用虚线表示。
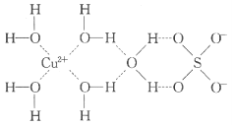
(1)写出基态Cu原子的核外电子排布式____,S原子的价层电子排布图______
(2)写出胆矾晶体中水合铜离子的结构简式_____(必须将配位键表示出来)。
(3)向CuSO4溶液中滴加氨水,可以得到深蓝色的溶液,再加入乙醇后析出深蓝色晶体,写出深蓝色晶体的化学式_____。比较NH3和[Cu(NH3)4]2+中H-N-H 中键角的大小:NH3_____[Cu(NH3)4]2+(填“![]() ” “
” “![]() ” 或“=”)。
” 或“=”)。
(4)已知H2O2的结构如图:
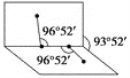
H2O2分子不是直线形的,两个H原子犹如在半展开的书的两面纸上,书页角为93°52′,而两个O—H键与O—O键的夹角均为96°52′,估计它难溶于CS2,简要说明原因______。
(5)分析下表中两种物质的键能数据(单位:kJ/mol)。
A—B | A=B |
| |
CO | 357.7 | 798.9 | 1 071.9 |
N2 | 154.8 | 418.4 | 941.7 |
结合数据说明CO比N2活泼的原因:_________。
【答案】1s22s22p63s23p63d104s1或[Ar]3d104s1 ![]()
 [Cu(NH3)4]SO4H2O < 因H2O2为极性分子,而CS2为非极性溶剂,根据相似相溶规律,H2O2难溶于CS2中 CO中第一个断裂的π键的键能是273kJ/mol,N2中第一个断裂的π键的键能是523.3kJ/mol,所以CO的第一个键比N2更容易断
[Cu(NH3)4]SO4H2O < 因H2O2为极性分子,而CS2为非极性溶剂,根据相似相溶规律,H2O2难溶于CS2中 CO中第一个断裂的π键的键能是273kJ/mol,N2中第一个断裂的π键的键能是523.3kJ/mol,所以CO的第一个键比N2更容易断
【解析】
(1)铜是29号元素,其原子核外有29个电子,根据构造原理书写其基态原子核外电子排布式;硫是16号元素,其核外电子排布式为1s22s22p63s23p4,根据价电子排布式3s23p4书写其价层电子排布图;
(2) CuSO45H2O中铜离子含有空轨道,水分子含有孤对电子对,铜离子与水分子之间形成配位键,铜离子配体数为4;
(3)硫酸铜加氨水生成的深蓝色物质是铜氨络合离子,析出的晶体是铜氨络合物。由于NH3提供孤对电子与Cu2+形成配位键后,N-H成键电子对受到的排斥力减小,所以H-N-H键角增大;
(4)判断H2O2、CS2分子的极性,依据相似相溶的原理解答;
(5)根据断裂三键中的中的一个![]() 键消耗的能量判断。
键消耗的能量判断。
(1)铜是29号元素,其原子核外有29个电子,根据构造原理知,其基态原子核外电子排布式为:1s22s22p63s23p63d104s1或[Ar]3d104s1,硫原子核外电子排布式为1s22s22p63s23p4,价电子排布式3s23p4,则其价层电子排布图为![]() ;
;
因此,本题正确答案是:1s22s22p63s23p63d104s1或[Ar]3d104s1;![]() ;
;
(2) CuSO45H2O中铜离子含有空轨道,水分子含有孤对电子对,铜离子与水分子之间形成配位键,铜离子配体数为4。水合铜离子的结构简式为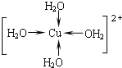 ,
,
因此,本题正确答案是: ;
;
(3)向深蓝色透明溶液加入乙醇,由于乙醇能降低溶解度,有利于晶体析出,所以[Cu(NH3)4]SO4H2O在乙醇中的溶解度小于在水中的溶解度,故会析出深蓝色的晶体:[Cu(NH3)4]SO4H2O;由于NH3提供孤对电子与Cu2+形成配位键后,N-H成键电子对受到的排斥力减小,所以H-N-H键角增大,所以键角的大小:NH3<[Cu(NH3)4]2+,
因此,本题正确答案是:[Cu(NH3)4]SO4H2O;<;
(4)相似相溶原理是指由于极性分子间的电性作用,使得极性分子组成的溶质易溶于极性分子组成的溶剂,难溶于非极性分子组成的溶剂;非极性分子组成的溶质易溶于非极性分子组成的溶剂,难溶于极性分子组成的溶剂,H2O2是极性分子,CS2是非极性分子,依据相似相溶的原理可知,H2O2难溶于CS2,
因此,本题正确答案是:因H2O2为极性分子,而CS2为非极性溶剂,根据相似相溶规律,H2O2难溶于CS2中;
(5)根据表中数据可知,断裂C≡O中的一个π键消耗的能量是1071.9kJ/mol-798.9kJ/mol=273kJ/mol,断裂N≡N中的一个π键消耗的能量是941.7kJ/mol-418.4kJ/mol=523.3kJ/mol,断裂一个π键CO比N2更容易,所以CO更活泼,
因此,本题正确答案是:CO中第一个断裂的π键的键能是273kJ/mol,N2中第一个断裂的π键的键能是523.3kJ/mol,所以CO的第一个键比N2更容易断。

【题目】铜及其化合物在工业生产上有许多用途。某工厂以辉铜矿(主要成分为 Cu2S,含少量 Fe2O3、SiO2 等杂质)为原料制备不溶于水的碱式碳酸铜的流程如下:
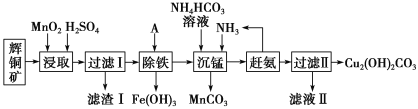
已知:
①常温下几种物质开始形成沉淀与完全沉淀时的pH如下表
金属离子 | Fe2+ | Fe3+ | Cu2+ | Mn2+ |
开始沉淀 | 7.5 | 2.7 | 5.6 | 8.3 |
完全沉淀 | 9.0 | 3.7 | 6.7 | 9.8 |
②Ksp[Fe(OH)3]=4.0×10-38
(1)加快“浸取”速率,除将辉铜矿粉碎外,还可采取的措施有____(任写一种)。
(2)滤渣I中的主要成分是MnO2、S、SiO2,请写出“浸取”反应中生成S的化学方程式:____。
(3)常温下“除铁”时加入的试剂A可用CuO等,调节pH调的范围为____,若加 A 后溶液的 pH调为5,则溶液中 Fe3+的浓度为____mol/L。
(4)写出“沉锰”(除 Mn2+)过程中反应的离子方程式:____。
(5)“赶氨”时,最适宜的操作方法是____。
(6)滤液Ⅱ经蒸发结晶得到的盐主要是____(写化学式)。
(7)过滤Ⅱ得到的沉淀经过洗涤、干燥可以得到碱式碳酸铜,判断沉淀是否洗净的操作是____。