题目内容
[化学——物质结构与性质]
(1)金属钛(22Ti) 将是继铜、铁、铝之后人类广泛使用的第四种金属,写出Ti元素的基态原子电子排布式为 ;
(2)日常生活中广泛应用的不锈钢,在其生产过程中添加了铬元素,该元素基态原子未成对电子数为 。
(3)COCl2俗称光气,分子中C原子采取 杂化成键;其中碳氧原子之间的共价键含有 (填字母): a.2个σ键;b.2个π键;c.1个σ键、1个π键。
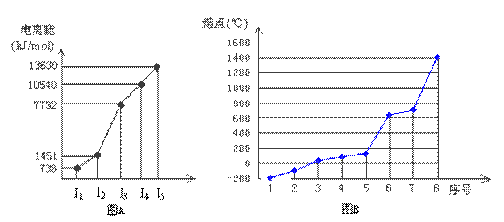
(4)①短周期某主族元素M的逐级电离能情况如下图A所示,则M元素位于周期表的第
族。
②第三周期8种元素按单质熔点高低的顺序如下图B所示,其中序号“8”代表 (填元素符号);其中电负性最大的是 (填图B中的序号)。
(5)由C原子跟Si原子以1 : 1相互交替结合而形成的晶体,晶型与晶体Si相同。两者相比熔点更高的是 (填化学式)试从结构角度加以解释: 。
(6)在配合物Fe(SCN)2+中,提供空轨道接受孤对电子的微粒是 。
(1)1s22s22p63s23p63d24s2 (2分) (2)6(2分)
(3)sp2 (1分) c(1分) (4)①ⅡA (1分) ②Si(1分);2(1分)
(5)SiC(1分);因SiC晶体与晶体Si都是原子晶体,由于C的原子半径小,SiC 中C—Si 键键长比晶体Si 中Si—Si键短,键能大,因而熔沸点高(2分)
(6)Fe3+(1分)

练习册系列答案
 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案
相关题目

 ”表示该晶体中的一个原子,请在该立方体的顶点上用“
”表示该晶体中的一个原子,请在该立方体的顶点上用“ ”表示出与之紧邻的原子.
”表示出与之紧邻的原子.
 ,平面结构)属于
,平面结构)属于 (2013?菏泽二模)[化学-物质结构与性质]
(2013?菏泽二模)[化学-物质结构与性质]