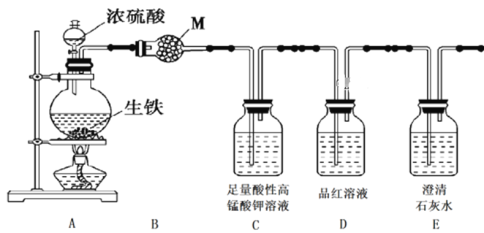
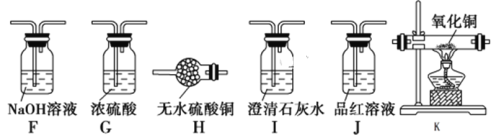
题目内容
【题目】下列离子方程式书写正确的是
A. 向明矾溶液中加入过量氢氧化钡溶液:SO42-+Ba2+ ![]() BaSO4↓
BaSO4↓
B. 向CH3COOH中加入足量的氢氧化钠溶液: CH3COOH+OH- ![]() CH3COO-+H2O
CH3COO-+H2O
C. 向氢氧化亚铁中加入足量的稀硝酸:Fe(OH)2 +2H+![]() Fe2++2H2O
Fe2++2H2O
D. 向碳酸氢铵溶液中加入足量的氢氧化钠溶液:NH4++ OH- ![]() NH3·H2O
NH3·H2O
【答案】B
【解析】
A.向明矾溶液中加入过量的氢氧化钡溶液,反应的离子方程式为: Al3++SO42-+Ba2++4OH- ![]() BaSO4↓+ AlO2-+2H2O,故A错误; B.向CH3COOH中加入足量的氢氧化钠溶液,反应的离子方程式为: CH3COOH+OH-
BaSO4↓+ AlO2-+2H2O,故A错误; B.向CH3COOH中加入足量的氢氧化钠溶液,反应的离子方程式为: CH3COOH+OH- ![]() CH3COO-+H2O,故B正确;C.向氢氧化亚铁中加入足量的稀硝酸,反应的离子方程式为: 3Fe(OH)2 +NO3-+10H+
CH3COO-+H2O,故B正确;C.向氢氧化亚铁中加入足量的稀硝酸,反应的离子方程式为: 3Fe(OH)2 +NO3-+10H+![]() 3Fe3++8H2O+NO
3Fe3++8H2O+NO![]() ,故C错误;D.向碳酸氢铵溶液中加入足量的氢氧化钠溶液,反应的离子方程式: NH4++HCO3-+ 2OH-
,故C错误;D.向碳酸氢铵溶液中加入足量的氢氧化钠溶液,反应的离子方程式: NH4++HCO3-+ 2OH- ![]() CO32+-NH3·H2O+H2O,所以D错误的;答案:B。
CO32+-NH3·H2O+H2O,所以D错误的;答案:B。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目