题目内容
合成氨尿素工业生产过程中涉及到的物质转化过程如下图所示.
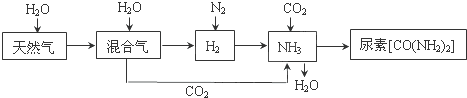
(1)天然气(主要成分为CH4)在高温、催化剂作用下与水蒸气反应生成H2和CO的化学方程式为
(2)甲烷是一种清洁燃料,但不完全燃烧时热效率降低,同时产生有毒气体造成污染.
已知:CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H1=-890.3kJ/mol
2CO(g)+O2(g)=2CO2(g)△H2=-566.0kJ/mol
则甲烷不完全燃烧生成一氧化碳和液态水时的热效率是完全燃烧时的
(3)甲烷燃料电池可以提升能量利用率.下图是利用甲烷燃料电池电解50mL 2mol?L-1的氯化铜溶液的装置示意图:
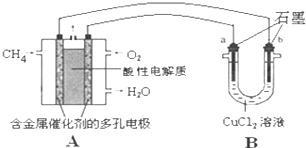
请回答:
①甲烷燃料电池的正极反应式是
②当线路中有0.1mol电子通过时,
(4)运输氨时,不能使用铜及其合金制造的管道阀门.因为在潮湿的环境中,金属铜在有NH3存在时能被空气中的O2氧化,生成[Cu(NH3)4]2+,该反应的离子方程式为

(1)天然气(主要成分为CH4)在高温、催化剂作用下与水蒸气反应生成H2和CO的化学方程式为
CH4+H2O
CO+3H2
| ||
CH4+H2O
CO+3H2
.
| ||
(2)甲烷是一种清洁燃料,但不完全燃烧时热效率降低,同时产生有毒气体造成污染.
已知:CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H1=-890.3kJ/mol
2CO(g)+O2(g)=2CO2(g)△H2=-566.0kJ/mol
则甲烷不完全燃烧生成一氧化碳和液态水时的热效率是完全燃烧时的
0.7
0.7
倍(计算结果保留1位小数).(3)甲烷燃料电池可以提升能量利用率.下图是利用甲烷燃料电池电解50mL 2mol?L-1的氯化铜溶液的装置示意图:

请回答:
①甲烷燃料电池的正极反应式是
O2+4 H++4e-═2H2O
O2+4 H++4e-═2H2O
.②当线路中有0.1mol电子通过时,
b
b
(填“a”或“b”)极增重3.2
3.2
g.(4)运输氨时,不能使用铜及其合金制造的管道阀门.因为在潮湿的环境中,金属铜在有NH3存在时能被空气中的O2氧化,生成[Cu(NH3)4]2+,该反应的离子方程式为
2Cu+8NH3+O2+2H2O═2[Cu(NH3)4]2++4OH-
2Cu+8NH3+O2+2H2O═2[Cu(NH3)4]2++4OH-
.分析:(1)甲烷与水蒸气反应生成一氧化碳和氢气;
(2)依据热化学方程式和盖斯定律计算得到不完全燃烧的热化学方程式进行计算得到;
(3)①原电池负极发生氧化反应,甲烷在负极通入,酸性条件下,发生氧化反应生成CO2、H+;正极是氧气得到电子发生还原反应;
②、B为电解池,铜离子发生还原反应,在阴极析出,该极连接原电池的负极,根据转移电子计算生成Cu的物质的量,再根据m=nM计算生成Cu的质量.
(4)铜在有NH3存在时能被空气中的O2氧化,生成Cu(NH3)42+,以此书写离子反应;
(2)依据热化学方程式和盖斯定律计算得到不完全燃烧的热化学方程式进行计算得到;
(3)①原电池负极发生氧化反应,甲烷在负极通入,酸性条件下,发生氧化反应生成CO2、H+;正极是氧气得到电子发生还原反应;
②、B为电解池,铜离子发生还原反应,在阴极析出,该极连接原电池的负极,根据转移电子计算生成Cu的物质的量,再根据m=nM计算生成Cu的质量.
(4)铜在有NH3存在时能被空气中的O2氧化,生成Cu(NH3)42+,以此书写离子反应;
解答:解:(1)甲烷与水蒸气反应生成一氧化碳和氢气,该反应为CH4+H2O
CO+3H2,故答案为:CH4+H2O
CO+3H2;
(2)①CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H1=-890.3kJ/mol
②2CO(g)+O2(g)=2CO2(g)△H2=-566.0kJ/mol
烷不完全燃烧生成一氧化碳和液态水时的热化学方程式依据盖斯定律①×2-②得到:2CH4(g)+3O2(g)=2CO(g)+4H2O(l)△H=-1214.6KJ/mol;
1mol甲烷不完全燃烧的热效率是完全燃烧的
=0.7;
故答案为:0.7;
(3)①原电池负极发生氧化反应,甲烷在负极通入,酸性条件下,发生氧化反应生成CO2、H+,负极电极反应式为:CH4-8e-+2H2O=CO2+8H+,正极是氧气得到电子发生还原反应,电极反应为:O2+4 H++4e-═2H2O;
故答案为:O2+4 H++4e-═2H2O;
②B为电解池,铜离子发生还原反应,在阴极析出,该极连接原电池的负极,故在b电极析出Cu,b电极的质量增重,转移0.1mol电子,析出铜的物质的量为
=0.05mol,故析出铜的质量为0.05mol×64g/mol=3.2g,
故答案为:b; 3.2;
(4)铜在有NH3存在时能被空气中的O2氧化,生成Cu(NH3)42+,该离子反应为2Cu+8NH3+O2+2H2O═2Cu(NH3)42++4OH-;
故答案为:2Cu+8NH3+O2+2H2O═2Cu(NH3)42++4OH-.
| ||
| ||
(2)①CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H1=-890.3kJ/mol
②2CO(g)+O2(g)=2CO2(g)△H2=-566.0kJ/mol
烷不完全燃烧生成一氧化碳和液态水时的热化学方程式依据盖斯定律①×2-②得到:2CH4(g)+3O2(g)=2CO(g)+4H2O(l)△H=-1214.6KJ/mol;
1mol甲烷不完全燃烧的热效率是完全燃烧的
| ||
| 890.3 |
故答案为:0.7;
(3)①原电池负极发生氧化反应,甲烷在负极通入,酸性条件下,发生氧化反应生成CO2、H+,负极电极反应式为:CH4-8e-+2H2O=CO2+8H+,正极是氧气得到电子发生还原反应,电极反应为:O2+4 H++4e-═2H2O;
故答案为:O2+4 H++4e-═2H2O;
②B为电解池,铜离子发生还原反应,在阴极析出,该极连接原电池的负极,故在b电极析出Cu,b电极的质量增重,转移0.1mol电子,析出铜的物质的量为
| 0.1mol |
| 2 |
故答案为:b; 3.2;
(4)铜在有NH3存在时能被空气中的O2氧化,生成Cu(NH3)42+,该离子反应为2Cu+8NH3+O2+2H2O═2Cu(NH3)42++4OH-;
故答案为:2Cu+8NH3+O2+2H2O═2Cu(NH3)42++4OH-.
点评:本题考查了热化学方程式和盖斯定律的计算应用,原电池原理分析.电极反应书写方法,电子守恒计算应用离子方程式单位产物判断和书写方法应用,题目难度中等.

练习册系列答案
相关题目
硝酸是一种重要的工业原料,工业制硝酸的关键是氨的催化氧化,与硝酸工业相关的过
程中产生的氮氧化物的处理与应用也是科学研究的热点。
I.甲、乙分别是实验室模拟合成氨及氨催化氧化的装置
 |
⑴ 氮气和氢气通过甲装置,甲装置的作用除了将气体混合外,还有控制气体流速、 ▲ 。
⑵ 用乙装置吸收一段时间氨后,再通入空气,同时将经加热的铂丝插入乙装置的锥形瓶内,铂丝保
持红热的原因是 ▲ ,写出乙装置中氨氧化的化学方程式 ▲ 。反应结束后锥形瓶内的溶
液中含有H+、OH-、 ▲ 、 ▲ 离子。
II.工业生产硝酸的尾气中含有氮氧化物NOx(NO和NO2的混合物,假设不含N2O4),对生态环境和人类健康带来较大的威胁。
⑴ 工业上常用Na2CO3溶液吸收法处理NOx 。
已知:NO不能与Na2CO3溶液反应
NO + NO2 + Na2CO3 = 2NaNO2 + CO2 ①
2NO2 + Na2CO3 = NaNO2 + NaNO3 + CO2 ②
当NOx被Na2CO3溶液完全吸收时,x的值不可能是 ▲ (填字母)。
A.1.3 B.1.6 C.1.8
⑵ 尿素也可用于吸收处理NOx,其反应原理为:
NO+NO2+H2O=2HNO2
2HNO2+CO(NH2)2=2N2↑+CO2↑+3H2O。
当混合气体中NO、NO2按上述反应中系数比时吸收效果最佳。若混合气体中V(NO)∶V(NO2)=5∶1时,可通入一定量的空气,同温同压下,V(空气)∶V(NO)= ▲ (空气中氧气的体积含量约为20%)。