��Ŀ����
����Ŀ����12�֣���֪���ᣨHCOOH����������ᣬ��������������ʣ���ʵ�����ﳣ�ü�����Ũ�������������ȡ����һ����̼�����ü�����״���Ӧ��ȡ�����������֤�����ܷ���������Ӧ��װ������ͼ��ʾ���ش��������⣺
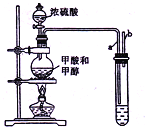
��1��ʵ�������ѡ���Լ�����Ʒ��Ũ���ᡢ�״������ᣬ����____________��___________�������ʡ�
��2�����Թ�����Һ���������ܽ�״������ռ��ᣬ����_____________��
��3�������Թ�����Һ��NaOH��Һ�����ռ����IJ����Ԥ�ڵ��٣���ԭ����______
��4�����ɼ�������ķ�Ӧ�Ļ�ѧ����ʽΪ__________��
��5����ʵ������е���b___����ܡ����ܡ���ֱ���������ͨ������Ϊ______��
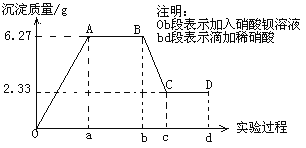
���𰸡� ����Na2CO3��Һ ���Ƭ ���������ܽ�ȣ������������� ��������ڼ���������ˮ����һ���� HCOOH+CH3OH![]() HCOOCH3+H2O ���� CO��CH3OH�����ж����ʣ��Ի�������Ⱦ
HCOOCH3+H2O ���� CO��CH3OH�����ж����ʣ��Ի�������Ⱦ
������������ʵ�����Ʊ����������ķ�Ӧ���ƿ�֪��1��ʵ�������ѡ�õ��Լ�����Ʒ��Ũ���ᡢ�״������ᣬ���б���Na2CO3��Һ�����Ƭ(���ʯ)����2�����Թ�����Һ���������ܽ�״������ռ��ᣬ���н��ͼ��������ˮ�е��ܽ�ȣ����ڷֲ���������������3�����ڼ��������NaOH��Һ���ڵ�������ˮ����һ�����������ռ����IJ����Ԥ�ڵ�������4����ʵ������е���b����ֱ���������ͨ������ΪCO��CH3OH�����ж������ҶԻ�������Ⱦ����5�����ɼ�������Ļ�ѧ��Ӧ����ʽΪHCOOH+CH3OH![]() HCOOCH3+H2O��
HCOOCH3+H2O��

 ���Ͱ�ͨ��ĩ���ϵ�д�
���Ͱ�ͨ��ĩ���ϵ�д�����Ŀ��ij�о���ѧϰС��Ϊ��̽������ĵ������������������ʵ�飺
��ʵ��һ�����Ʋ��궨������Һ��Ũ�ȡ�ȡ����������250 mL 0.2 mol��L��1�Ĵ�����Һ��Ȼ����0.2 mol��L��1�Ĵ�����Һϡ�ͳ�����Ũ�ȵ���Һ������NaOH����Һ����ϡ�͵Ĵ�����Һ��Ũ�Ƚ��б궨����ش��������⣺
��1������250 mL 0.2 mol��L��1������Һʱ��Ҫ�õ��IJ�����������Ͳ���ձ�����������__________��
��2��Ϊ�궨ij������Һ��ȷŨ�ȣ���0.200 0 mol��L��1��NaOH��Һ��20.00 mL������Һ���еζ������εζ�����NaOH��Һ��������£�
ʵ����� | 1 | 2 | 3 | 4 |
����NaOH��Һ �����(mL) | 20.05 | 20.00 | 18.40 | 19.95 |
�����ζ�ʱѡ��________(A.ʯ�B����̪��C������ָʾ�� D.����)Ϊָʾ��������ĸ��
���ô�����Һ��ȷŨ��Ϊ________(����С�������λ)��
��ʵ�����̽��Ũ�ȶԴ������̶ȵ�Ӱ�졣��pH�Ʋⶨ25 ��ʱ��ͬŨ�ȵĴ�����Һ��pH��������£�
����Ũ�� (mol��L��1) | 0.001 0 | 0.010 00 | 0.020 0 | 0.100 0 | 0.200 0 |
pH | 3.88 | 3.38 | 3.23 | 2.88 | 2.83 |
��3�����ݱ������ݣ����Եó�������������ʵĽ��ۣ�����Ϊ�ó��˽��۵�������_________________��
��4���ӱ��е����ݣ������Եó���һ���ۣ����Ŵ���Ũ�ȵļ�С������ĵ���̶�______(��������������С������������)��
��ʵ������̽���¶ȶԴ������̶ȵ�Ӱ�졣
��5��Ҫ��ɸ�̽������Ҫ��pH��(��pH��ֽ)�ⶨ ___________________________��
����������Ӧ�á�
��6��ͨ��ʵ��ⶨ�����´����Ka��1��10��5����0.1 mol��L��1��������Һ��pH��________��