��Ŀ����
����Ŀ��ij��ѧ��ȤС��̽��SO2��FeCl3��Һ�ķ�Ӧ������װ����ͼ��ʾ(�г���������ȥ)��
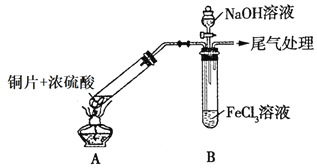
(1)ͼ��ʢ��NaOH��Һ�IJ�������������______��
(2)ʵ��ǰ��Ӧ�ȼ��װ�õ�______��ʵ�鿪ʼ��Aװ�����Թ��ڷ�����Ӧ�Ļ�ѧ����ʽΪ______��ʵ���в���β����ͨ��______(��д��ѧ�Լ�)�������մ�����
(3)B�Թ���װ��5mL1molL-1FeCl3��Һ��������ͨ��������SO2���壬B�Թ��е�ʵ������Ϊ______��д���÷�Ӧ�����ӷ���ʽ______��
���𰸡���Һ©�� ������ Cu+2H2SO4![]() CuSO4+SO2��+2H2O NaOH��Һ ��Һ�ɻ�ɫ��Ϊdz��ɫ 2Fe3++SO2+2H2O=SO42-+4H++2Fe2+
CuSO4+SO2��+2H2O NaOH��Һ ��Һ�ɻ�ɫ��Ϊdz��ɫ 2Fe3++SO2+2H2O=SO42-+4H++2Fe2+
��������
(1)ʢװNaOH��Һ������������¿ڰ�װһ��ͨ�ṹ�Ļ�������������ͨ�ֱ������¹����ӣ�Ϊ��Һ©����
(2)��ȡ����ķ�Ӧװ�ã���ȡ֮ǰӦ���װ�õ������ԣ�Cu+2H2SO4![]() CuSO4+SO2��+2H2O����������β����NaOH��Һ���գ�
CuSO4+SO2��+2H2O����������β����NaOH��Һ���գ�
(3)SO2��FeCl3�ķ���������ԭ��Ӧ�������������������ᣬ��Ӧ����Ϊ���ɻ�ɫ��Ϊdz��ɫ�����ӷ�ӦΪ��2Fe3++SO2+2H2O=SO42-+4H++2Fe2+��

 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�����Ŀ����10 L�����ܱ������г���X(g)��Y(g)��������ӦX(g)��Y(g) ![]() M(g)��N(g)������ʵ���������±���
M(g)��N(g)������ʵ���������±���
ʵ�� ��� | �¶�/�� | ��ʼʱ���ʵ���/mol | ƽ��ʱ���ʵ���/mol | ||
n(X) | n(Y) | n(M) | |||
�� | 700 | 0.40 | 0.10 | 0.090 | |
�� | 800 | 0.10 | 0.40 | 0.080 | |
�� | 800 | 0.20 | 0.30 | a | |
�� | 900 | 0.10 | 0.15 | b | |
����˵����ȷ����(����)
A. ʵ�����У���5 minʱ���n(M)��0.050 mol����0��5 minʱ���ڣ���N��ʾ��ƽ����Ӧ����v(N)��1.0��10��2 mol��L��1��min��1
B. ʵ�����У��÷�Ӧ��ƽ�ⳣ��K��2.0
C. ʵ�����У��ﵽƽ��ʱ��X��ת����Ϊ60%
D. ʵ�����У��ﵽƽ��ʱ��b>0.060