题目内容
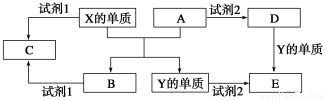
A、B、D、E四种元素均为短周期元素,原子序数逐渐增大。A元素原子的核外电子数、电子层数和最外层电子数均相等。B、D、E三种元素在周期表中的相对位置如图①所示,只有E元素的单质能与水反应生成两种酸。甲、乙、M、W、X、Y、Z七种物质均由A、B、D三种元素中的一种或几种组成,其中只有M分子同时含有三种元素;W为A、B两元素组成的18电子分子,可作火箭燃料;甲、乙为非金属单质;X分子含有10个电子。它们之间的转化关系如图②所示。
B | D |
|
|
| E |
图①
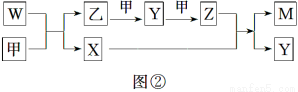
请回答下列问题:
(1)Z的化学式为__________________。
(2)E的单质与水反应的离子方程式为________________________________________。
(3)W?空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液。W?空气燃料电池放电时,正极反应式为________________________________,负极反应式为____________________。
(4)将一定量的A2、B2的混合气体放入1 L密闭容器中,在500 ℃、2×107 Pa下达到平衡。测得平衡气体的总物质的量为0.50 mol,其中A2为0.3 mol,B2为0.1 mol。则该条件下A2的平衡转化率为________,该温度下的平衡常数为____________(结果保留3位有效数字)。
(1)NO2
(2)Cl2+H2O H++Cl-+HClO
H++Cl-+HClO
(3)O2+2H2O+4e-=4OH- N2H4+4OH--4e-=N2+4H2O
(4)33.3% 3.70
【解析】(1)根据A元素原子的核外电子数、电子层数和最外层电子数均相等,可得出A元素为H;结合常见元素及其化合物的性质和E元素的单质能与水反应生成两种酸,可知E元素是Cl,并得出D元素是O、B元素是N。根据M分子同时含有三种元素可知,M可能是HNO3,甲、乙是非金属单质,可得出乙是N2、甲是O2,并得出Y是NO、Z是NO2;X分子含有10个电子,可能是水或NH3,但如果是NH3,与Z无法反应生成HNO3,因此X是H2O,结合W含有18个电子,可知W是N2H4。(2)反应方程式为Cl2+H2O HCl+HClO,次氯酸是弱酸。(3)先写出总反应式N2H4+O2=N2+2H2O,在碱性条件下,通入氧气的一极为正极O2+2H2O+4e-=4OH-,最后相减得出负极的电极反应式。(4)平衡时A2为0.3 mol、B2为0.1 mol、BA3为0.1 mol,起始时A2为0.45 mol,已转化0.15 mol,得出转化率约为33.3%,并进一步计算出平衡常数。
HCl+HClO,次氯酸是弱酸。(3)先写出总反应式N2H4+O2=N2+2H2O,在碱性条件下,通入氧气的一极为正极O2+2H2O+4e-=4OH-,最后相减得出负极的电极反应式。(4)平衡时A2为0.3 mol、B2为0.1 mol、BA3为0.1 mol,起始时A2为0.45 mol,已转化0.15 mol,得出转化率约为33.3%,并进一步计算出平衡常数。

 步步高达标卷系列答案
步步高达标卷系列答案下列各组物质中,物质之间通过一步反应就能实现图示变化的是( )
物质编号 | 物质转化关系 | a | b | c | d |
① |
| FeCl2 | FeCl3 | Fe | CuCl2 |
② | NO | NO2 | N2 | HNO3 | |
③ | Na2O | Na2O2 | Na | NaOH | |
④ | Al2O3 | NaAlO2 | Al | Al(OH)3 |
A.①④ B.①②③ C.①③④ D.②④
已知短周期元素甲、乙、丙、丁、戊的原子序数依次增大,其氢化物中甲、乙、丙、丁、戊的化合价如下,下列说法正确的是( )
元素 | 甲 | 乙 | 丙 | 丁 | 戊 |
化合价 | -4 | +1 | -4 | -2 | -1 |
A.乙的常见氧化物只有一种
B.气态氢化物稳定性:丙>丁
C.丙的氧化物能与戊的氢化物的水溶液反应
D.原子半径大小:戊<丙
有一无色透明溶液,欲确定是否含有下列离子:K+、Mg2+、Al3+、Fe2+、Ba2+、NO3-、SO42-、Cl-、I-、HCO3-,取该溶液进行如下实验:
实验步骤 | 实验现象 |
①取少量该溶液,加几滴甲基橙溶液 | 溶液变红色 |
②取少量该溶液,加入铜片和浓硫酸,加热 | 有无色气体产生,遇空气可以变成红棕色 |
③取少量该溶液,加入BaCl2溶液 | 有白色沉淀生成 |
④取③中的上层清液,加入AgNO3溶液 | 有稳定的白色沉淀生成,且不溶于稀硝酸 |
⑤取少量该溶液,加入NaOH溶液 | 有白色沉淀生成,当NaOH过量时,沉淀部分溶解 |
由此判断:
(1)溶液中一定存在的离子是______________;溶液中肯定不存在的离子是________________________。
(2)为进一步确定其他离子,应该补充的实验及对应欲检验离子的名称(若为溶液反应,说明使用试剂的名称,不必写详细步骤)________________________________________。
(3)写出实验⑤中所有反应的离子方程式:______________________________。