题目内容
6.各1mol的Na、Mg、Al分别与足量稀盐酸充分反应,则所产生H2的物质的量之比为1:2:3.分析 Na、Mg、Al与盐酸反应生成H2,由关系式:Na~HCl~$\frac{1}{2}$H2,Mg~2HCl~H2,Al~3HCl~$\frac{3}{2}$H2,以此解答.
解答 解:各1mol的Na、Mg、Al分别与足量稀盐酸充分反应,反应的关系式为Na~HCl~$\frac{1}{2}$H2,Mg~2HCl~H2,Al~3HCl~$\frac{3}{2}$H2,
由此可知分别生成氢气的物质的量为0.5mol、1mol、1.5mol,则物质的量之比为1:2:3.
故答案为:1:2:3.
点评 本题考查化学方程式有关计算,比较基础,注意利用电子转移守恒或反应的转化式进行计算.

练习册系列答案
 学习实践园地系列答案
学习实践园地系列答案
相关题目
16.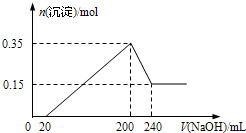 将一定质量的Mg和Al的混合物投入500mL稀硫酸中,固体全部溶解并产生气体.待反应完全后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如图所示.则下列说法正确的是( )
将一定质量的Mg和Al的混合物投入500mL稀硫酸中,固体全部溶解并产生气体.待反应完全后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如图所示.则下列说法正确的是( )
 将一定质量的Mg和Al的混合物投入500mL稀硫酸中,固体全部溶解并产生气体.待反应完全后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如图所示.则下列说法正确的是( )
将一定质量的Mg和Al的混合物投入500mL稀硫酸中,固体全部溶解并产生气体.待反应完全后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如图所示.则下列说法正确的是( )| A. | Mg和Al的总质量为8 g | |
| B. | 硫酸的物质的量浓度为5 mol/L | |
| C. | NaOH溶液的物质的量浓度为5 mol/L | |
| D. | 生成的H2在标准状况下的体积为11.2 L |
14.下列各分子中所有原子都满足最外层为8电子结构的是( )
| A. | CO2 | B. | PCl5 | C. | NH3 | D. | HClO |
1.将5.1g镁铝合金溶于70mL 4mol/L硫酸中,当合金完全溶解后,再加入70mL 8mol/L的NaOH溶液,得沉淀的质量为13.6g,则加入硫酸时,产生H2的物质的量为( )
| A. | 0.2 mol | B. | 0.25 mol | C. | 0.3 mol | D. | 0.35 mol |
4.n g N2中有m个N原子,则阿伏加德罗常数NA的数值可表示为( )
| A. | $\frac{28m}{n}$ | B. | $\frac{14m}{n}$ | C. | $\frac{n}{28m}$ | D. | $\frac{n}{14m}$ |

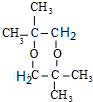 ,该分子的核磁共振氢谱有2种峰.
,该分子的核磁共振氢谱有2种峰. .F→G的反应:(CH3)2C(OH)-CHO+2Cu(OH)2$\stackrel{△}{→}$(CH3)2C(OH)-COOH+Cu2O↓+2H2O.
.F→G的反应:(CH3)2C(OH)-CHO+2Cu(OH)2$\stackrel{△}{→}$(CH3)2C(OH)-COOH+Cu2O↓+2H2O.