题目内容
【题目】环境监测显示,某地市的主要气体污染物为SO2,NOx,CO等,其主要来源为燃煤、机动车尾气。进行如下研究:
(1)为减少燃煤对SO2的排放,可将煤转化为清洁燃料水煤气(CO和H2)。
已知:H2(g)+1/2O2(g)=H2O(g)△H=-241.8kJ/mol
C(s)+1/2O2(g)=CO(g)△H=-110.5kJ/mol
写出焦炭与水蒸气反应的热化学方程式______;
(2)汽车尾气中NO是在发动机气缸中生成的,反成为:N 2(g)+O 2(g) ![]() 2NO(g) △H>0
2NO(g) △H>0
①将含0.8 mol N2和0.2molO2(近似空气组成)的混合气体充入某密闭容器中,保持1300℃反应达到平衡,测得生成8×10-4molNO 。计算该温度下此反应的化学平衡常数K=_______(填近似计算结果)。
②汽车启动后,汽缸内温度越高,单位时问内NO排放最越大,原因是______________。
(3)利用如图所示装置(电极均为惰性电极)可吸收SO2,并利用阴极排出的溶液吸收NO2。
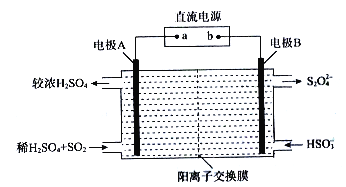
①电极A的电极反应式为________________;电极B的电极反应式为_____________。
②碱性条件下,用阴极排出的溶液吸收NO2,使其转化为无害气体,同时生成SO32-。该反应的离子方程式为_______________。
【答案】 C(s)+H2O(g)=CO(g)+H2(g) △H=+131.3 kJ.mol-l 4×10-6 温度升高,反应速率加快且平衡正向移动 SO2+2H2O-2e-=SO42-+4H+ 2HSO3-+2H++2e- =S2O42-+2H2O 4S2O42-+2NO2+8OH- =8SO32-+ N2+4H2O
【解析】(1)①已知:ⅠH2(g)+![]() O2(g)=H2O(g)△H=-241.8KJ/mol,ⅡC(s)+
O2(g)=H2O(g)△H=-241.8KJ/mol,ⅡC(s)+![]() O2(g)=CO(g)△H=-110.5KJ/mol,利用盖斯定律计算反应热,将Ⅱ-Ⅰ可得C(s)+H2O(g)=CO(g)+H2(g)H=+131.3KJ/mol;
O2(g)=CO(g)△H=-110.5KJ/mol,利用盖斯定律计算反应热,将Ⅱ-Ⅰ可得C(s)+H2O(g)=CO(g)+H2(g)H=+131.3KJ/mol;
(2)①已知气缸中生成NO的反应为:N2(g)+O2(g)2NO(g)△H>0.若气缸中进入1mol空气(1mol空气含有0.8molN2和0.2molO2),1300℃时在密闭容器内反应达到平衡.测得NO为8×10-4mol,反应前后气体物质的量相同,计算平衡常数时可以用物质的量代替平衡浓度计算,先计算物质的平衡量,N2为0.8mol-4×10-4 mol,O2为0.2mol-4×10-4 mol,带入平衡常数表达式即可,书写计算得K=![]() =4×10-6;
=4×10-6;
②气缸温度越高,单位时间内NO排放量越大,原因是温度升高,反应速率加快,平衡右移;
(3)①依据图示可知,阳极A电极上SO2发生氧化反应,电极反应式为SO2+2H2O-2e-=SO42-+4H+;阴极B电极上HSO3-得电子生成S2O42-,阴极区发生反应2HSO3-+2H++2e-=S2O42-+2H2O;
②阴极排出的溶液为S2O42-,二氧化氮与其发生反应,S2O42-中硫元素由+3价,变为硫酸根中硫元素为+4价,S2O42-被氧化是还原剂;二氧化氮中的氮元素化合价为+4价变为氮气0价,二氧化氮被还原为氧化剂,依据原子守恒和得失电子守恒可得,发生的离子方程式为4S2O42-+2NO2+8OH-═8SO42-+N2+4H2O。

 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案
