题目内容
【题目】有X、Y、Z、W、A、B六种元素。其相关信息如下:

请回答下列有关问题:
(1)根据信息分析元素Y是________ (填元素符号),A在元素周期表中的位置是________。
(2)BX3分子的中心原子采取的杂化类型是_____________。
(3)光谱证实单质 Z与强碱溶液反应生成[Z(OH)4]-,该原子的空间构型是_________,[Z(OH)4]-离子中存在的化学键有_____________(填字母)
A.极性共价键 B.非极性共价键 C.配位键 D. σ键 E. π键
(4)Y与W可形成离子化合物,其晶胞结构如下图所示。W离子采取的堆枳方式是_________, W离子的配位数为__________,W离子的配位数为_______,Y离子占据空位(填“四面体或八面体”)。若该晶体的密度为dg·cm-3,则该晶胞中最近的Y离子与W离子间的距离是______cm,(设NA为阿佛加德罗常数的值,只需列出计算表达式〉

【答案】 F 第四周期VIII族 sp3 正四面体型 ACD 面心立方堆积(或A1型堆积) 8 四面体 ![]()
【解析】有X、Y、Z、W、A、B六种元素。X原子的1s轨道上只有1个电子,则X为H元素;Y是电负性最大的元素,则Y为F元素;根据Z的电离能数据可知,Z为第三周期第ⅢA族元素,为Al元素;W是主族元素且与A同周期,其最外层上有两个运动状态不同的电子,则W为第ⅡA元素,A是过渡金属元素,根据其外围电子排布可知,A为Fe元素,则W为Ca元素;B的基态原子2P轨道中有三个未成对电子,核外电子排布为1s22s22p3,故B为N元素。
(1)根据上述分析,元素Y是F元素,A为Fe元素,在元素周期表中位于第四周期VIII族,故答案为:F;第四周期VIII族;
(2) NH3分子的中心原子N上连接有3个原子,含有1个孤电子对,采取的杂化类型是sp3,故答案为:sp3;
(3) [Al(OH)4]-中Al原子与四个原子相连,没有孤电子对,采取的杂化类型是sp3,该离子的空间构型是正四面体型,[Al(OH)4]-离子中存在的化学键有极性键、配位键和σ键 ,故答案为:正四面体型; ACD;
(4)根据图示,Ca离子采取面心立方堆积,由晶胞结构可知晶体中与钙离子距离最近的氟离子有8个;晶胞中钙原子数目为8×![]() +6×
+6×![]() =4、F原子数目为8,化学式为CaF2,晶胞的质量为
=4、F原子数目为8,化学式为CaF2,晶胞的质量为![]() g,晶体密度为ρg/cm3,则晶胞体积为
g,晶体密度为ρg/cm3,则晶胞体积为![]() g÷dg/cm3,故晶胞棱长x=
g÷dg/cm3,故晶胞棱长x= cm;F原子与周围4个Ca原子形成正四面体结构,令F与Ca之间的距离为y,则正四面体中心到底面中心的距离为
cm;F原子与周围4个Ca原子形成正四面体结构,令F与Ca之间的距离为y,则正四面体中心到底面中心的距离为![]() ,正四面体的高为
,正四面体的高为![]() y,正四面体棱长=
y,正四面体棱长=![]() ,则正四面体侧面的高为
,则正四面体侧面的高为![]() ×
×![]() ,底面中心到边的距离为
,底面中心到边的距离为![]() ×
×![]() ×
×![]() ,故(
,故(![]() y)2+(
y)2+(![]() ×
×![]() ×
×![]() )2=(
)2=(![]() ×
×![]() )2,整理得:y=
)2,整理得:y=![]() x,故F与Ca的距离为:
x,故F与Ca的距离为: ![]() ×
×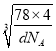 ;故答案为:面心立方堆积;8;四面体;
;故答案为:面心立方堆积;8;四面体; ![]() ×
× 。
。

【题目】以菱镁矿(主要成分为MgCO3、含少量FeCO3、SiO2)制备高纯氧化镁的流程如下图所示:

己知:25℃时,指示剂变色pH范围和几种氢氧化物的ksp及pH的关系如下表:
指示剂 | 酚酞 | 甲基酸 |
变色范围(pH) | 8.2-10.0 | 3.1-4.4 |
氢氧化物 | Fe(OH)3 | Fe(OH)2 | Mg(OH)2 |
开始沉淀时pH | 1.1 | 5.9 | 8.4 |
沉淀完全时pH | 3.7 | 9.6 | 10.2 |
溶度积常数 | 4×10-34 | 8×10-16 | 2×10-13 |
(1)操作II和III中涉及的分离方法分别是____________、_______________。
(2)残渣I的主要成分是____________,加入H2O2的过程中可观察到的现象是___________,其中发生的离子反应方程式是_________________________。
(3)MgSO4和木炭在800℃煅烧时,只生成MgO和两种气体,将混合气体通入NaOH溶液时,气体被完全吸收。煅烧时发生反应的化学方程式是_____________。
(4)采用滴定法测定溶液II与加入氨水的最佳体积比,可以减少氨水的消粍和Mg2+的损失。实验中应选取_______________指示剂,加入氨水是为了沉淀溶液II中的___________离子,若终点时该离子浓度=1.0×10-5mol·L-1,则溶液III的pH=_____________(己知:lg2=0.3)。


